
- •3.2.1.1 Материальный баланс для верха абсорбера
- •3.2.2 Тепловой баланс верхней части абсорбера а – 1
- •3.2.3 Химический состав насыщенного абсорбента, поступающего из верхней части абсорбера в нижнюю.
- •3.2.4 Расчет числа тарелок для верхней части абсорбера
- •3.2.5 Расчет нижней части абсорбера
- •3.2.6 Тепловой баланс нижней части абсорбера
- •3.2.7 Химический состав насыщенного абсорбента, покидающего аппарат.
- •3.2.4 Расчет числа тарелок для нижней части абсорбера
3.2.3 Химический состав насыщенного абсорбента, поступающего из верхней части абсорбера в нижнюю.
Водный раствор МДЭА содержит в растворенном и химически связанном состояниях. Поглощение в абсорбере сероводорода раствором МДЭА описывается следующими стехиометрическими уравнениями химических реакций
![]()
![]()
где
![]()
Константы химического равновесия в форме, принятой в литературе [8, c. 246], имеют вид:
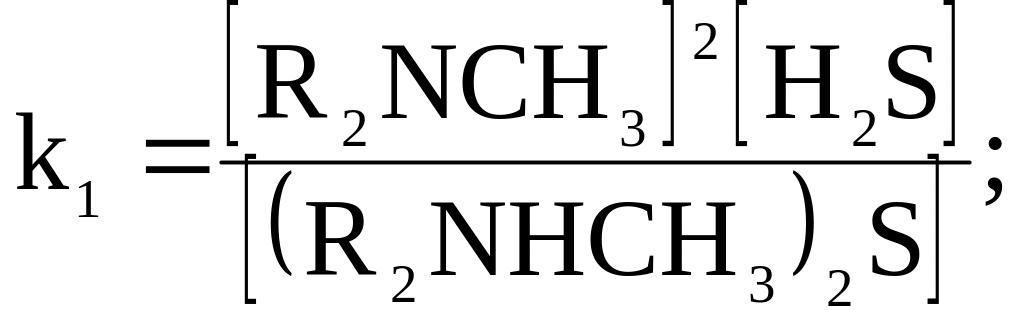
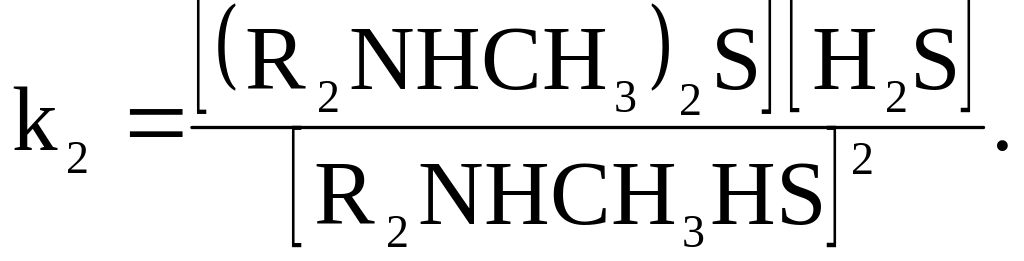
В квадратные скобки заключены количества молей веществ.
С учетом давления в аппарате и протекания реакций в растворе константы равновесия можно записать так [9, c. 265]:

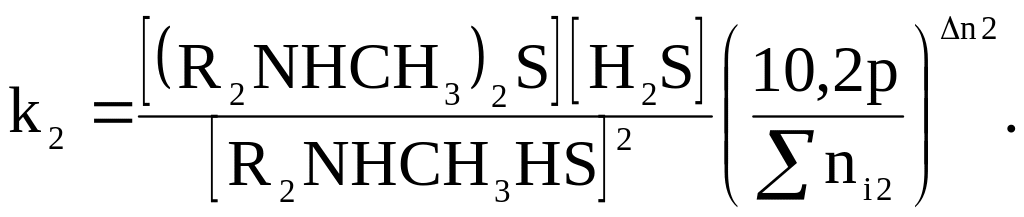
где р – давление в аппарате, МПа;
![]() -
общее число молей реагирующей смеси;
-
общее число молей реагирующей смеси;
![]() -
разность чисел молей продуктов и исходных
реагентов в реакциях (1) – (2).
-
разность чисел молей продуктов и исходных
реагентов в реакциях (1) – (2).
Константа химического равновесия связана с изменением стандартного изобарного потенциала [10, c. 230]:
![]()
где
![]() - изменение стандартного изобарного
потенциала для j
– ой реакции, кДж/моль;
- изменение стандартного изобарного
потенциала для j
– ой реакции, кДж/моль;
Расчеты констант химического равновесия осуществляются при температуре насыщенного абсорбента T = 321 К и давлении p = 1,2 МПа.
Изменение изобарного потенциала реакции рассчитывается по уравнению [10, c. 232]:
![]()
где
![]() -
изменение энтальпии образования,
кДж/моль;
-
изменение энтальпии образования,
кДж/моль;
![]() - изменение энтропии
реакции,
- изменение энтропии
реакции,
![]() .
.
Изменение изобарного потенциала для реакции (1) равно:
![]()
при этом
![]()
![]()
где
![]() - энтальпии образования веществ, кДж/моль;
- энтальпии образования веществ, кДж/моль;
![]() энтропии
веществ,
.
энтропии
веществ,
.
Числовые значения энтальпии образования и энтропии веществ для реакций (1)-(2) приведены в табл. При этом энтальпии и энтропии для соединений, содержащих радикал R, рассчитаны суммированием стандартных энтальпий и энтропий для элементов, входящих в состав соединений.
Таблица - Стандартные
энтальпии H0
образования и энтропии S0
при температуре t
= 25
![]() [10]
[10]
Элемент, соединение, ион |
H0,
|
S0,
|
Элемент, соединение, ион |
H0, |
S0, |
1 |
2 |
3 |
4 |
5 |
6 |
|
-51,036 |
219,592 |
|
2,805 |
22,190 |
|
42,118 |
183,746 |
|
133,382 |
595,338 |
|
142,3 |
192 |
|
513,587 |
798,528 |
|
-20,160 |
205,776 |
|
493,114 |
715,212 |
|
377,4 |
181 |
|
-17,668 |
-61,126 |
Тогда
![]()
![]()
Аналогично
рассчитаны числовые значения величин
![]()
![]()
Подстановка числовых значений величин в уравнение для расчета изменения изобарного потенциала дает:
![]()
![]()
Тогда
![]()
![]()
![]()
![]()
Число киломолей
,
полученных по реакции (1), следует
обозначить через
![]() и для расчета равновесного превращения
пользоваться следующей схемой (в
дальнейшем ее запись опускается):
и для расчета равновесного превращения
пользоваться следующей схемой (в
дальнейшем ее запись опускается):
Реакция:
![]() ;
;
Число киломолей:
- в исходной смеси: 3
- в равновесной
смеси:
![]()
- всего в равновесной
смеси:
![]()
Разность чисел
киломолей:
![]()
Тогда в соответствии
с найденным уравнением для константы
химического равновесия
![]() можно
записать:
можно
записать:
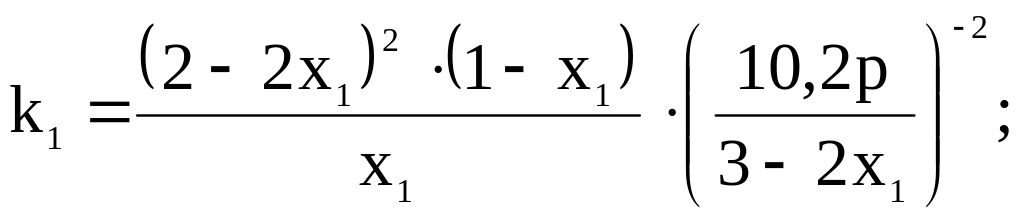

Значение
определяется методом подбора;
![]()
Уравнение для
расчета
![]() имеет вид:
имеет вид:

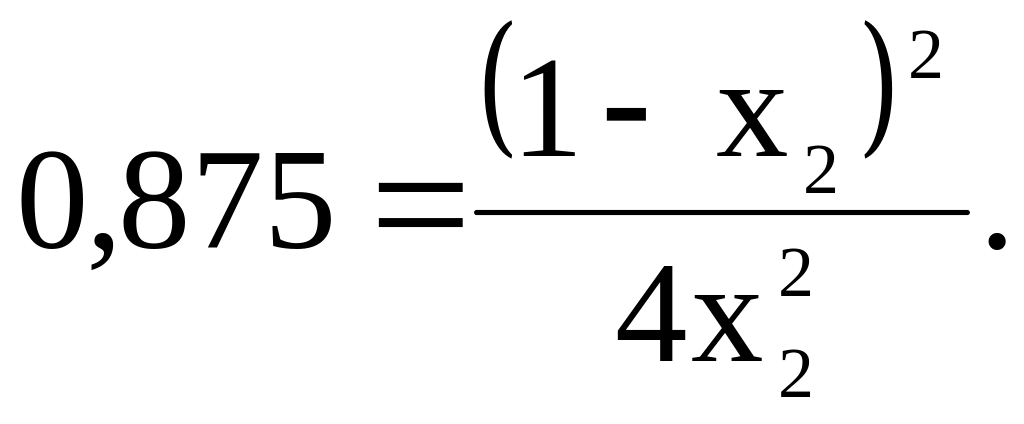
Значение
определяется методом подбора;
![]()
Для получения в количестве кмоль/ч по реакции (1):
![]()
необходимо знать количество прореагировавших веществ.
Количество исходного равно:
![]()
По реакции (1) прореагировали вещества в количествах:
![]()
![]()
Получено по реакции (1):
![]()
или

После реакции (1) в насыщенном абсорбенте остаются непрореагировавшими:
![]()
![]()
Для получения в количестве 2 кмоль/ч по реакции (2):
![]()
необходимо знать количество прореагировавших веществ.
По реакции (2) прореагировали вещества в количествах:
![]()
![]()
Получено по реакции (2):
![]()
После реакции (2) в насыщенном абсорбенте остаются непрореагировавшими:
![]()
![]()
С учетом содержания остаточного в абсорбенте количество , растворенное в насыщенном абсорбенте равно:
![]()
Расчет состава насыщенного абсорбента, выводимого с верхней части аппарата, дан в таблице
Таблица - Расчет состава насыщенного абсорбента, выводимого с верхней части аппарата
Компонент |
Мольная масса |
Количество |
Содержание |
|
|||
|
кмоль/ч |
масс. доли |
мольн. доли |
||||
|
18 |
10380 |
576,36 |
0,5891 |
0,8989 |
16,181 |
|
|
119 |
6677,1 |
56,11 |
0,3789 |
0,0874 |
10,408 |
|
|
34 |
244,3 |
7,18 |
0,0138 |
0,0112 |
0,381 |
|
|
272 |
198 |
0,73 |
0,0112 |
0,0011 |
0,308 |
|
|
153 |
119,1 |
0,78 |
0,0067 |
0,0012 |
0,185 |
|
|
16 |
0,15 |
0,01 |
|
|
0,0002 |
|
|
30 |
0,35 |
0,01 |
|
|
0,0005 |
|
|
- |
17619 |
641,48 |
1 |
1 |
27,465 |
|
