
- •Лекція 2
- •Властивості атомів
- •Орбітальні радіуси атомів та іонів.
- •II. Наступними важливими характеристиками атомів елементів є енергія іонізації (іонізаційний потенціал) та енергія спорідненості до електрону.
- •Ііі. Валентний стан атома.
- •IV. Орбітальні електронегативності
- •V. Поляризованість атомів та іонів.
- •VI. Кислотно- основні властивості атомів та іонів.
Лекція 2
Властивості атомів
Становлення кристалохімії, яке припадає на початок ХХ ст. і пов'язане з відкриттям Лауе, співпадає в часі з розвитком квантово-механічних уявлень про будову атома і описом стану електрона в атомі ( Н.Бор, Л.де Бройль, Є.Шредінгер, В.Гейзенберг, П.Дірак). Тому кристалохімію можна назвати теорією атомної структури кристалу.
Якщо фізика і квантова хімія твердого тіла дає розуміння кристалу, як колективу ядер і електронів, то для кристалохімії він, перш за все, є колективом атомів. Тому на всіх етапах вивчення структури кристалу і його властивостей кристалохімія намагається зберегти за атомами хімічних елементів їх індивідуальність. Вона пов'язує всі особливості кристалічної структури з характером атомів, що її утворюють, та їх взаємодією.
Тому і слід почати ( у стислій формі) з аналізу деяких властивостей “будівельних одиниць” кристалів – атомів.
Орбітальні радіуси атомів та іонів.
Однією з найважливіших характеристик атома є його розмір, який визначається радіусом. Згідно з квантово-механічними уявленнями, атоми не мають чітких меж, тому визначають орбітальні і ефективні радіуси атомів і іонів.
Розраховані методами квантової механіки радіуси головних максимумів радіальної густини електронів на окремих орбіталях атомів та іонів називаються орбітальними радіусами. Орбітальний радіус не є межею поширення електронної густини у даному стані, а вказує лише на найбільшу ймовірність перебування електрона саме на цій відстані від ядра. Зрозуміло, що і поза цією сферою, ймовірність перебування електрона є досить великою, хоча і швидко зменшується з віддаленням електрона від ядра. Однак саме орбітальні радіуси використовуються для характеристики розмірів атома чи іона у вільному стані, тобто до утворення ним хімічного зв'язку. Орбітальні радіуси перебувають у чіткій періодичній залежності від положення елемента в Періодичній системі (тобто від заряду ядра):
Різке зменшення орбітального радіуса атома по періоду зліва направо у кожному періоді. ( починає період лужний Me з mах орбітальним радіусом, н-д, r0Na=1,713Å, і закінчує інертний газ з min орб. радіусом, , r0Ar=0,659Å). При цій загальній тенденції спостерігаються невеликі стрибки після заселення наполовину заповнених 3d (Cr), 4f (Cd) дрівнів, які пов'язані з вторинною періодичністю. (r0V=1,401;(3d4) r0Cr=1,453; r0Mn=1,278).
( r0Eu=1,826; r0Gd=1,713; (4f8) r0Tb=1,775; r0Dy=1,750).
Зміна орбітальних радіусів по групах відзначається різким збільшенням при переході від II до III періоду , від III до IV, а далі йде плавна зміна, аж до деякого зменшення орбітальних радіусів найважчих атомів.
Табл.1
-
I гр.
Li
Na
K
Rb
Cs
Fr
R0
1,586
1,713
2,162
2,287
2,518
2,447
II гр.
Be
Mg
Ca
Sr
Ba
Ra
R0
1,040
1,279
1,690
1,836
2,060
2,042
Це стосується елементів головних підгруп (S- I p-елементів) для елементів побічних підгруп (d-) зміна радіуса є незначною і пояснюється лантаноїдним стиском. Він і є причиною деякого зменшення орб. радіусів 5d-елементів.
Розглянемо радіуси іонів, що володіють оболонками інертних газів (елементи n-ного періоду, атоми яких віддали таку кількість електронів, що відповідає номеру групи, перетворюються у катіони з електронною оболонкою інертного газу( n-1) періоду; а атоми, які прийняли кількісь електронів, що відповідає (8-N(номер групи)), перетворюються в аніони з електронною оболонкою інертного газу n-ного періоду).
-
4d
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
R0
1,93
1,593
1,589
1,520
1,391
1,410
1,364
0,567
1,286
1,184
5d
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
R0
1,915
1,476
1,413
1,360
1,310
1,266
1,227
1,221
1,187
1,126
Для катіонів спостерігається плавний хід збільшення радіусу по кривій, що є продовженням лінії після інертного газу (спостерігається відставання для катіонів V3+, Cr3+, Mn3+, Fe3+ та ін.) Ще більше відхиляються від такої лінії орбітальні радіуси неповно валентних катіонів p-елементів ( Sn2+ ,As3+, Pb2+).
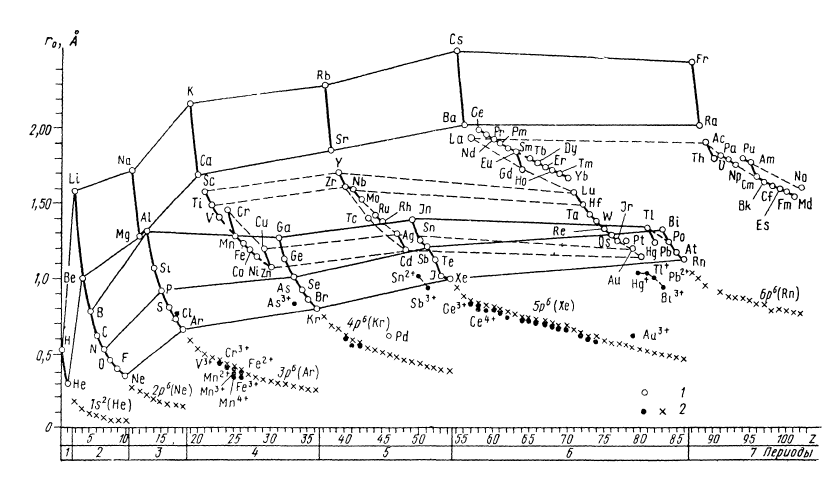
Рис.1 орбітальні радіуси атомів (1) та іонів (2)
Для аніонів орбітальні радіуси F-, Cl-, Br-, I- є дуже близькими до орбітальних радіусів відповідних атомів, навіть для F- радіус трошки менший за радіус атома (rF0=0,396, rF-=0,369). У зв'язку з цим, варто звернути увагу на те, що іонізація катіонів в межах однієї електронної оболонки взагалі мало змінює значення орбітальних радіусів (радіуси V2+ і V 3+, Mn2+ і Mn3+ і т.д. є деже близькими). І навпаки, різниця орбітальних радіусів нейтральних атомів і відповідних катіонів є досить великою (rLi=1,586, rLi+=0,189), у випадку коли вона пов'язана із зміною головного квантового числа електронів, які утворюють зовнішню оболонку.
