
- •Раствор перекиси водорода
- •1. На альдегидную группу
- •2. На карбоксильную группу
- •3. На ароматическую аминогруппу Ar–nh2
- •4. На фенольный гидроксил Ar–oh
- •2.Фармакопейный анализ препаратов (латинское и русское название, строение препарата, химическое название, получение, качественный анализ, хранение, применение):
- •Качественные реакции на катионы
- •Фармакопейная статья Aqua purificata «Вода очищенная»
- •Описание
- •Выписка из приказа № 305 от 16.10.97 г. «о нормах отклонений, допустимых при изготовлении лекарственных средств и фасовки промышленной продукции в аптеках»
- •Инструкция по оценке качества лекарственных средств, изготовленных в аптеках
- •Нормы отклонений, допустимые при изготовлении лекарств в аптеках
- •Отклонения, допустимые в массе отдельных доз суппозиториев и пилюль
- •Нормы отклонений, допустимые при фасовке промышленной продукции в аптеках
- •Молярные массы лекарственных веществ
- •Рефрактометрическая таблица некоторых наиболее часто применяемых в аптеках лекарственных средств
- •Журнал регистрации результатов контроля «воды очищенной», «воды для инъекций»
- •Журнал регистрации результатов контроля лекарственных средств на подлинность1
гбоу спо НО «нижегородский медицинский колледж»
Рабочая тетрадь
по МДК 02.02 Контроль качества лекарственных средств
Студента группа
ФИО
Нижний Новгород, 2013
Содержание стр Анализ раствора кислоты хлористоводородной. . . . . . . . . . . . . . . . . . . . . . . 1 Анализ концентрированного раствора натрия бромида. . . . . . . . . . . . . . . . .2 Анализ раствора калия йодида . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3 Семинар №1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4 Анализ воды очищенной . . . .. . . . . . . . . . . . . . . .. . . . . . . . . . . . . . . . . . 5 Анализ воды для инъекций . . . . . . . . . . .. . . . .. . .. . . .. …… . .. . .. . .. . . .. .6 Анализ раствора перекиси водорода . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7 Анализ раствора натрия тиосульфата . . . . . . . . . . . . . . . . . . . . . . . . . .. .. . ..8 Семинар №2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 Внутриаптечный контроль глазных капель с борной кислотой . . .. . . . . . . 10 Внутриаптечный контроль раствора натрия тетрабората… .. .. . . . . . . . .. .12 Анализ концентрированного раствора натрия гидрокарбоната. . .. . . . . . . .13 Семинар №3. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . . . .14 Анализ концентрированного раствора кальция хлорида. . .. . . . . . . . . .. . . .15 Анализ концентрированного раствора магния сульфата. . .. . . . . . . . . .. . . .16 Анализ раствора протаргола (внутриаптечная заготовка) . . .. . . . . . . . . . . .17 Семинар №4. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . 19 Обобщяющий тест «Неорганические лекарственные средства». .. . . . . . . .20 Контрольная работа №1. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . ... 21 Качественный анализ на функциональные группы. . .. . . . . . . . . .. . . . . . . . 22 Внутриаптечный контроль спирта этилового. . .. . . . . . . . . .. . . . . . . . . .. . . 24 Анализ концентрированного раствора метенамина. . . . . . . . .. . . . . . . . . .. .25 Внутриаптечный контроль микстуры с глюкозой. . .. . . . . . . . . .. . . . . . . . . 26 Семинар №5. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . 27 Внутриаптечный контроль лекарственных форм с дифенгидрамина гидрохлоридом. . .. . . . . . . . . .. . . . . . . . . .. . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . .28 Внутриаптечный контроль раствора кальция глюконата (внутриаптечная заготовка и фасовка) . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . . . . . . . . . . . .. . . . . 29 Внутриаптечный контроль порошков с аскорбиновой кислотой. . . . . . . . . 30 Семинар №6. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . 32 Анализ раствора натрия бензоата.. . . . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . .33 Анализ концентрированного раствора натрия салицилата.. ... . . . . . . . . . .34. Анализ суппозиториев с новокаином. . .. . . . . . . . . .. . . . . . . . . .. . . . .. . . .35 Анализ раствора новокаина для внутреннего применения. . .. . . . . . . . . .36 Анализ раствора сульфацила натрия. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . .37 Семинар №7. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . 38 Внутриаптечный контроль порошков с анальгином. . . .. . . . . . . . .. . . . . .39 Анализ порошков дибазола. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . 40 Семинар №8. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . .. . .41 Анализ полуфабриката никотиновой кислоты. . .. . . . . . . . . .. . . . . . . . . . 42 Анализ порошков пиридоксина.гидрохлорида. . . . . . . . . . . . . . . . . . … . .44 Семинар №9. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . . 45 Анализ порошков с тиамина бромидом. . .. . . . . . . . . .. . . . . . . . . .. . . . . . 46 Семинар №10. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . ..47 Внутриаптечный контроль глазных капель с атропина сульфатом. .. . . . 48 Внутриаптечный контроль инъекционных растворов с новокаином. . . ..49 Анализ раствора глюкозы.. .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . .50 Внутриаптечный контроль порошков с папаверина гидрохлоридом. . . . 51 Семинар №11. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . .52 Анализ раствора кофеина бензоата натрия. . . . . . . . . . .. . . . . . . . . . . . . . .53 Анализ порошков с эуфиллином.. . . . . . . . .. . . . . . . . . .. . . . . . . . . . . . . . . 54 Анализ раствора рибофлавина. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . . . . . . 55 Контрольная работа по теме: «Гетероциклические лекарственные средства» . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .56 Профессиональных задач по контролю качества лекарственных форм. . 57 Итоговый тест. . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . .. . . . . . . . . . . . . . . . . . 58 Приложение №1 Качественные реакции на катионы . . . . . . . . . . . . . . . . .62 Приложение №2 Качественные реакции на функциональные группы . . 65 Приложение №3 Фармакопейная статья «вода очищенная» . . . . . . . . . . .67 Приложение №4 Приказ №305. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 69 Приложение №5 Молярные массы лекарственных веществ. . . . . . . . . . . 73 Приложение №6 Рефрактометрическая таблица. . . . . . . . . . . . . . . . . . . . .74 Приложение №7 Журнал регистрации результатов контроля лекарств. .75 Приложение №8 Журнал регистрации результатов контроля воды . .. . .76 Приложение №9 Журнал регистрации результатов контроля на подл. ..77
Работа с рецептом |
Письменный контроль |
Качественный контроль |
Количественный контроль |
Оформление результатов |
|
|
|||
Бланк 107-У, штамп ЛПУ, личная печать и подпись врача. Сpок действия pецепта 2 месяца. Дозы не завышены. |
ППК Aquae purificatae 160ml Solutionis Acidi hydrochlorici 1:10-40 ml Pepsini 2,0 V = 200 мл |
Пpовести качественные pеакции :
1.На H+ c метилоpанжем – pозовое окpашивание.
2.На
Cl–
– ион
:
Cl–
+ AgNO3
белый творожистый осадок
AgCl+2NH4OH→[Ag(NH3)2]Cl + 2H2O [Ag(NH3)2]Cl +2HNO3→AgCl↓ + 2NH4NO3
3. Пpовести pеакцию на пепсин: 1 мл микстуpы помещают в фарфоpовую чашку и остоpожно выпаpивают пpи нагpевании на водяной бане, избегая почеpнения остатка. После охлаждения пpибавляют 0,02 г антипиpина и 8–10 капель сеpной кислоты. Чеpез 5 мин. появляется зеленое окpашивание.
|
Определение содержания соляной кислоты. Метод кислотно-основного титрования: HCl + NaOH → NaCl + H2O
УЧHCl = 1; М. м.= 36,46; Э = М. м. = 36,46 г
Тусл
=
н.о. ± 4 %; 3,84 – 4,16 г Vmin
Vmax
=
1 мл микстуpы помещают в склянку для титpования, пpибавляют 2–3 капли метилового оpанжевого и титруют 0,1 М NaOH до оpанжево-желтого окpашивания. Расчет по фоpмуле:
VNaOH * kNaOH * Тусл * 200 m = -------------------------------------- а Количественное опpеделение пепсина: Метод pефpактометpии: н.о. ± 5 %; 1,9 – 2,0 г Fпепсина = 0,00146
Расчет по фоpмуле:
(n - n0) * 200 m = ------------------- F * 100
|
Оформить результаты анализа в журнале. На ППК и рецепте указать номер анализа и расписаться. |
Органолептический контроль |
Физический контроль |
Контроль при отпуске |
||
Основная этикетка «Внутреннее». Дополнительные этикетки: «Беречь от детей» «Хранить в прохладном месте» «Перед употреблением взбалтывать» |
||||
Бесцветная слегка опалесцирующая жидкость со специфическим запахом |
V = 200 ml н.о. ± 2 % 196 – 204 мл |
Sol. Acidi hydrochlorici 2 % 200 ml
Pepsini 2,0
1
M.D.S. По 1 стол. ложке 3 раза в деньSolutio Natrii bromidi 10% 1000 мл (концентрированный раствор)
Работа с рецептом |
Письменный контроль |
Качественный контроль |
Количественный контроль |
Оформление результатов |
|
|
|||
(не проводится) |
Проверить запись в лабораторно-фасовочном журнале: Натрия бромида 100,0 Воды очищенной 973 мл Раствор натрия бромида 10 %-1л |
Провести качественные реакции на Na+ 1.Na+ + Zn(UO2)3(CH3COO)8 +CH3COOH + 9H2O → NaZn(UO2)3(CH3COO)9•9H20↓ + H+ желтый кристаллический осадок
2.Соль натрия, смоченная хлористоводородной кислотой, окрашивает бесцветное пламя горелки в желтый цвет. на Br-:
1.Br– +AgNO3 AgBr ↓+ NO3– желтовато-белый, нерастворимый в NH4OH
2.2Br–
+ Cl2
|
Провести количественное определение методом рефрактометрии: Рассчитать н.о. ±2 %
9,8–10,2 % F 10% NaOH = 0,00118 Расчет по формуле: n - n0 C% = -----------, F где C – концентрация определяемого вещества в процентах; n – показатель преломления рефрактометрируемого раствора; n0 – показатель преломления воды очищенной; F – рефрактометрический фактор пересчета
|
Оформить результаты анализа в журнале. В лабораторно-фасовочном журнале поставить № анализа и расписаться. |
Органолептический контроль |
Физический контроль |
Контроль при отпуске |
||
Проверить этикетку. Sol. Natrii bromidi 10 % № серии. Дата приготовления. Поставить на этикетке № анализа. |
||||
Бесцветный, прозрачный раствор, без запаха и механических включений |
(не проводится) |
2
Sol. Kalii iodidi 3% 10 ml D.S. По 2 кап. 2 раза в день в оба глаза
Работа с рецептом |
Письменный контроль |
Качественный контроль |
Количественный контроль |
Оформление результатов |
|
|
|||
Бланк 107-1/у Штамп ЛПУ, личная печать и подпись врача. Срок действия рецепта 2 месяца. |
ППК
Аquae pro injectionibus 10ml Kalii iodidi 0,3 Voбщ = 10 мл |
Провести качественные реакции: на калий-ион: 1.K++NaHC4H4O6→KHC4H4O6↓+Na+ белый кристаллический осадок KHC4H4O6 + HCl → KCl + H2C4H4O6 KHC4H4O6 + KOH → K2C4H4O6 +H2O 2.2K+
+ Na3[Co(NO2)6]
3. Соль калия окрашивает бесцветное пламя горелки в фиолетовый цвет (при рассматривании через синее стекло – в пурпурно-красный) на йодид-ион : 1.J– + AgNO3 AgJ ↓+ NO3– желтый, нерастворимый в HNO3 и NH4OH
2.J– + 2NaNO2 + H2SO4 J2 + 2NO + Na2SO4 + SO42– + 2H2O окрашивание хлороформа в фиолетовый цвет 2J– + 2FeCl3 J2 + 2FeCl2 + 2Cl– синее окрашивание 2J– + Cl2 J2 + 2Cl– малиновое окрашивание |
Метод аргентометрии (вариант Фаянса)
KI + AgNO3 → AgI↓+ KNO3
УЧKJ = 1; M. м.= 166,01; TO,1M AgNO3 /KJ = 0,016601 г/мл н.о. ± 8 %; 0,276 – 0,324 г
Vmin
=
Vmax
=
К 0,5 мл раствора прибавляют 0,5 мл уксусной кислоты, 3 капли эозината натрия и титруют 0,1М раствором нитрата серебра до ярко-розового окрашивания осадка. Расчет по формуле:
m= |
Оформить результаты анализа в журнале На ППК и рецепте указать № анализа, расписаться. |
Органолептический контроль |
Физический контроль |
Контроль при отпуске |
||
Основная этикетка «Глазные капли» Дополнительная этикетка «Беречь от детей» «Стерилизовано» «Хранить в темном прохладном месте»
|
||||
Бесцветная прозрачная жидкость без запаха, без механических включений.
|
Vобщ = 10 мл н.о. ± 10 % 9 – 11 мл |
3
Семинар №1
“Лекарственные средства, производные элементов 7 группы ПСЭ”
1.Общая характеристика элементов (расположение в ПСЭ, строение атомов, степень окисления, соединения элементов). Биологическая роль и медицинское использование их соединений.
Cl, Br, I
2. Провести фармакопейный анализ препаратов (латинское название, строение препарата, получение, описание, подлинность, чистота, количественное определение, хранение, применение):
Кислота хлористоводородная;
Натрия и калия хлорид;
Натрия и калия бромид;
Йод, раствор йода 5%, 10%
3.Провести внутриаптечный анализ лекарственных форм:
Концентрированный раствор кислоты хлористоводородной 0,83%-1000 мл
Раствор натрия бромида 10% (1:10) – 2000 мл
В\а заготовка и фасовка: раствор калия йодида 0,5% - 100 мл №50
Rp: Калия хлорида 0,5
M.f. pulvis
D.t.d. №100
S. По 1 порошку 3 раза в день
Rp: Раствора кислоты хлористоводородной 2% - 150 мл
Пепсина 1,0
M.D.S. По 1 столовой ложке 3 раза в день
Rp: Раствора кислоты хлористоводородной 6% - 100 мл
D.S. Раствор №2 по Демьяновичу
4
Состав лекарственного средства: Aqua purificata (вода очищенная)
1. Работа с рецептом (не проводится).
2. Письменный контроль (не проводится).
3. Органолептический контроль:
бесцветная прозрачная жидкость без запаха и механических включений pH 5,0–7,0.
4. Физический контроль (не проводится).
5. Химический качественный контроль:
5.1. Определить отсутствие примесей Cl–, SO42–, Ca2+ по методике ФС «Вода очищенная»
5.2. Химизм реакций:
на хлорид-ион;
Cl– + AgNO3 AgCl↓+NO3– белый творожистый осадок
HCl
на сульфат-ион;SO42+BaCl2→BaSO4↓+2Cl–
белый осадок, нерастворимый в щелочах и кислотах
на
ион кальция.
Ca2+
+ (NH4)2C2O4
![]() CaC2O4↓
+ 2NH4+
CaC2O4↓
+ 2NH4+
6. Химический количественный контроль (не проводится)
7. Оформление результатов
7.1. Оформить результаты анализа в "Журнале регистрации результатов контроля "Воды очищенной", "Воды для инъекций".
8. Оформление к отпуску
8
5
.1. Проверить этикетку на штангласе Aqua purificata (вода очищенная).8.2. Поставить № анализа, подпись, дату
Состав лекарственного средства: Aqua pro injectionibus (вода для инъекций)
1. Работа с рецептом (не проводится)
2. Письменный контроль (не проводится)
3. Органолептический контроль
3.1. Бесцветная прозрачная жидкость без запаха и механических включений, pH 5,0–7,0
4. Физический контроль (не проводится)
5. Химический качественный контроль
5.1. Определить отсутствие примесей Cl–, SO42–, Ca2+, NH4+, CO2, восстанавливающих веществ по методике ФС «Вода очищенная».
5.2. Химизм реакций
на хлорид-ион; см. приложение №1
на сульфат-ион; см. приложение №1
на ион кальция; см. приложение №1
на ион аммония;
с реактивом Несслера
NH4+
+ 2K2HgJ4
+ 4KOH →7KJ +![]() + K+
+ 3H2O
+ K+
+ 3H2O
на углекислый газ.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
на восстанавливающие вещества
100 мл воды доводят до кипения, прибавляют 1 мл 0,01 М раствора перманганата и 2 мл кислоты серной разведенной, кипятят 10 мин; розовая окраска должна сохраниться.
5K2SO4 +2KMnO4+3H2SO4→6K2SO4 +2MnSO4 +3H2O
6. Химический количественный контроль (не проводится)
7. Оформление результатов
7.1. Оформить результаты анализа в "Журнале регистрации результатов контроля "Воды очищенной", "Воды для инъекций"
8. Оформление к отпуску
8.1. Проверить этикетку на штанглассе Aqua purificata pro injectionibus (вода очищенная для инъекций).
8
6
.2. Поставить на этикетке № анализа, подпись, дату.
Solutio Hydrogenii peroxydi diluta
Раствор перекиси водорода
H2O2
|
М.м. 34,01 |
Приготовление. В части воды растворяют пергидроль, а в другой части, при нагревании, растворяют антифебрин. После охлаждения раствор антифебрина добавляют к раствору пергидроля и тщательно перемешивают.
Описание. Бесцветная, прозрачная жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции. Быстро разлагается на свету, при нагревании, соприкосновении с окисляющими или восстанавливающими веществами, щелочами, некоторыми металлами (железом, медью, марганцем и др.), выделяя кислород.
Перекись водорода обладает или окислительными или восстановительными свойствами (с KJ, с KMnO4).
Подлинность.
1) Получение надхромовой кислоты.
К препарату прибавляют разведённую серную кислоту, эфир, несколько капель раствора бихромата калия и взбалтывают; эфирный слой окрашивается в синий цвет.
|
эфир |
|
H2O2 + K2Cr2O7 + H2SO4 → H2Cr2O8 + K2SO4 + H2O
|
надхромовая кислота |
2) Стабилизатор – антифебрин доказывают по реакции образования азокрасителя после выпаривания препарата и кипячения с соляной кислотой (реакция на первичный ароматический амин).
Количественное определение.
1) Редокс-метод (перманганатометрический).
10 мл препарата помещают в мерную колбу ёмкостью 100 мл и доводят объем раствора водой до метки. К 10 мл полученного раствора прибавляют 5 мл разведенной серной кислоты и титруют 0,1М раствором перманганата калия до слабого розового окрашивания.
5H2O2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 8H2O + 5O2
|
+5ē |
|
|
|
MnO4- + 8H+ |
→ |
Mn2+ + 4H2O |
|
2 |
|
|
|
10 |
|
(O2)2- - 2 ē |
→ |
O20 |
|
5 |
ЭH2O2 = М/2
 ,
где
,
где
V1 – объем колбы;
V2 – объем аликвотной части;
Препарата должно быть 2,7 – 3,3%.
2) ВАК. Рефрактометрический метод.
Хранение. В склянках с притёртыми стеклянными пробками, в прохладном, защищённом от света месте (заполнять до верху нельзя).
Применение. Наружно как антисептическое, вяжущее, кровоостанавливающее, дезодорирующее средство.
Антисептическое действие обуславливается окислительными свойствами перекиси водорода, которая выделяет кислород в присутствии ферментов каталазы крови. Каталаза быстро разлагает перекись водорода, при этом бурно выделяется кислород, что создает видимость пены.
П
7
рименяется в виде полосканий, промываний, при стоматитах, ангине, гинекологических заболеваниях и др.Sol.Natrii thiosulfatis 60 % 100 ml
Дай. Обозначь Раствор № 1 по Демьяновичу
Работа с рецептом |
Письменный контроль |
Качественный контроль |
Количественный контроль |
Оформление результатов |
|
|
|||
Бланк ф.107-У, штамп ЛПУ, личная печать и подпись врача Срок действия рецепта 2 месяца |
ППК Aq. purificatae q.s. Natrii thiosulfatis 85,0 Aq. purificatae ad 100 ml Vобщ=100мл |
Провести качественные реакции: на Na+: 1.
2.
на
S2O32-
:
1.S2O32–
+ 2AgNO3
AgS2O3↓→ S↓ + Ag2SO3 Ag2SO3 + S↓ + H2O → Ag2S↓ + H2SO4 2.S2O32– + 2HCl → S↓ + SO2 + 2Cl– желтый аморфный осадок, запах 2S2O32– + J2 → S4O62– + 2J- обесцвечивание желтого окрашивания
|
Натрия тиосульфат – метод рефрактометрии н.о. 3 % 58,2 – 61,8 Расчет по формуле:
(n - n0) * 100 m = ------------------- F * 100
|
Оформить результаты анализа в журнале На ППК и рецепте указать № анализа и расписаться
|
Органолептический контроль |
Физический контроль |
Контроль при отпуске |
||
Основная этикетка «Наружное» Дополнительная этикетка «Беречь от детей»
|
||||
|
|
8
Семинар №2
“Лекарственные средства, производные элементов 6 группы ПСЭ”
1. Общая характеристика элементов (расположение в ПСЭ, строение атомов, степень окисления, соединения элементов). Биологическая роль и медицинское использование их соединений.
O, S
2. Провести фармакопейный анализ препаратов (латинское название, строение препарата, получение, описание, подлинность, чистота, количественное определение, хранение, применение):
3. Провести внутриаптечный анализ лекарственных форм:
Rp: Раствора натрия тиосульфата 60% – 200 мл
D.S. Раствор №1 по Демьяновичу
Rp: Раствора кислоты хлористоводородной 6% - 200 мл
D.S. Раствор №2 по Демьяновичу
Внутриаптечный анализ воды очищенной, воды для инъекций
Применение в медицине серы осажденной
Вода очищенная, вода для инъекций;
Натрия тиосульфат
Перекись водорода;
9
Solutio Zinci sulfatis 0,25 % 20 ml Acidi boridi 0,2 D.S. Глазные капли № 20 (внутриаптечная заготовка и фасовка)
Работа с рецептом |
Письменный контроль |
Качественный контроль |
Количественный контроль |
Оформление результатов |
|
|
|||
(не проводится) |
Проверить запись в ЛФЖ Цинка сульфата 1,0 К-ты борной 4,0 Воды очищ 400 мл раствор цинка сульфата 0,25%- 20 мл кислоты борной 0,2 – 20 фл |
Провести качественные реакции:
на Zn2+ :
1. 3Zn2+ + 2K4[Fe(CN)6] → Zn3K2[Fe(CN)6]2↓ + 6K+ Белый студенистый осадок, не растворимый в HCl разбавленной
2. Zn2+ + Na2S → ZnS↓ +2Na+ белый аморфный осадок, не растворимый в CH3COOH
3. ZnS + 2HCl → ZnCl2 +H2S на SO42:
SO42+BaCl2→BaSO4↓+2Cl– белый осадок, нерастворимый в щелочах и кислотах на Н+: с индикатором (метиловый оранжевый) – появляется розовое окрашивание
на
борат-ион
BO33–
:
пламя с зеленой каймой
|
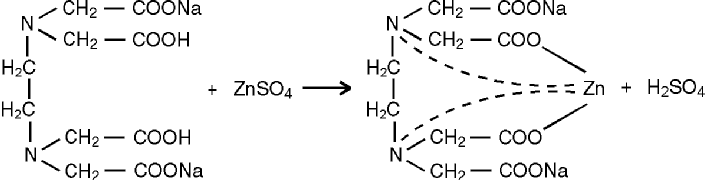
Количественное определение цинка сульфата провести методом комплексонометрии: ZnSO4 + H2Ind = ZnInd + H2SO4
ZnInd + H2 Тр б = Zn Тр б + H2Ind
УЧ = 1; М. м. ZnSO4 = 287,54
Т 0,05 М ТрБ/ZnSO4 = 0,01438 г/мл
Рассчитать н.о. в содержании цинка сульфата ± 6 % 0,94–1,06
Рассчитать объем титранта 0,05 М ТрБ, затраченный на 3 мл раствора
Vmin
=
Vmax
=
К 3 мл лекарственной формы прибавить 2 мл аммиачно-буферного раствора и 0,02 г индикатора – кислотного хрома темно-синего, титруют 0,05 М ТрБ от красно-фиолетового до синего окрашивания
Расчет по формуле:
VТрБ * k*T*400 m =---------------------------- a Количественное
определение борной кислоты провести
методом нейтрализации:
н.о. в содержании борной кислоты ± 4 % 3,84–4,16 Рассчитать объем титранта 0,1 М NaOH на 1 мл лекарственной формы Vmin = 1,55 мл Vmax = 1,68 мл
Титрование провести по методике: к 1 мл лекарственной формы прибавить 5 мл глицерина, нейтрализованного по фенолфталеину, и титруют 0,1 М NaOH в присутствии фенолфталеина до розового окрашивания.
|
Оформить результаты анализа в журнале В лабораторно-фасовочном журнале поставить № анализа и расписаться
|
Органолептический контроль |
Физический контроль |
Контроль при отпуске |
||
Основная этикетка «Глазные капли» Sol. Zinci sulfatis 0,25 % – 20 мл Acidi borici 0,2 Дата приготовления № серии «Стерилизовано» «Беречь от детей» № 10 анализа
|
||||
Бесцветная прозрачная жидкость без запаха и механических включений |
Vфасовки 20 мл;
н.о. ±8 %
18,4–21,6 мл
Количество флаконов – 20
|
11
Solutio Natrii tetraboratis 5 % 10 ml D.S.Наружно
Работа с рецептом |
Письменный контроль |
Качественный контроль |
Количественный контроль |
Оформление результатов |
|
|
|||
|
|
|
|
|
Органолептический контроль |
Физический контроль |
|
|
Контроль при отпуске |
12 |
||||
|
|
Solutio Natrii hydrocarbonatis 5% 2000 мл (концентрированный раствор)
Работа с рецептом |
Письменный контроль |
Качественный контроль |
Количественный контроль |
Оформление результатов |
|
|
|||
(не проводится) |
Проверить запись в лабораторно-фасовочном журнале Натрия гидрокарбоната 100,0 Воды очищенной 1966 мл Раствор натрия гидрокарбоната 5 % - 2 л
|
Провести качественные реакции: на Na+: 1.
2.
на HCO3– 1.
HCO3–
+ MgSO4
2. HCO3– + HCl → Cl– +H2O + CO2
|
Провести количественное определение методом рефрактометрии
Рассчитать н.о. ±2 % % - %
F5% NaHCO3 = 0,00125
Расчет по формуле
n - n0 C% = -----------, F
|
Оформить результаты анализа: |
Органолептический контроль |
Физический контроль |
Контроль при отпуске |
||
Проверить этикетку Sol. Natrii hydrocarbonatis 5 % № серии Дата приготовления Поставить на этикетке № анализа
|
||||
Бесцветный, прозрачный раствор, без запаха и механических включений |
(не проводится) |
13
Семинар №3
“Лекарственные средства, производные элементов 4, 3 групп ПСЭ”
1. Общая характеристика элементов (расположение в ПСЭ, строение атомов, степень окисления, соединения элементов). Биологическая роль и медицинское использование их соединений.
С, В
2. Провести фармакопейный анализ препаратов (латинское название, строение препарата, получение, описание, подлинность, чистота, количественное определение, хранение, применение):
Натрия гидрокарбонат;
Кислота борная;
Натрия тетраборат
3. Провести внутриаптечный анализ лекарственных форм:
Rp: Раствора цинка сульфата 0,25% – 20 мл
Кислоты борной 0,2
М.D.S. Глазные капли №20 (в\а заготовка и фасовка)
Rp: Раствора натрия тетрабората 2% в глицерине – 20 мл №10
Раствор натрия гидрокарбоната 5% - 5 л (концентрированный раствор)
Раствор борной кислоты 2% - 200 мл (полуфабрикат)
Уголь активированный, состав, получение, медицинское применение.
14
Solutio Calcii chloridi 50 % 1000 мл (концентрированный раствор)
Работа с рецептом |
Письменный контроль |
Качественный контроль |
Количественный контроль |
Оформление результатов |
|
|
|||
(не проводится) |
Проверить запись в лабораторно-фасовочном журнале Кальция хлорида Воды очищенной Раствор кальция хлорида 50 % – 1 л
|
Провести качественные реакции на Ca2+ : 1.Ca2+ + (NH4)2C2O4 CaC2O4↓ + 2NH4+ CaC2O4↓ + 2HCl → CaCl2 + H2C2O4
2. Соль кальция, смоченная хлористоводородной кислотой, окрашивает бесцветное пламя горелки в кирпично-красный цвет на Cl– – ион :
|
Провести количественное определение методом рефрактометрии
н.о. ±1 % 49,5–50,5 %
F50% CaCl2 = 0,00111
Расчет по формуле: n - n0 C% = -----------, F
|
Оформить результаты анализа в журнале
|
Органолептический контроль |
Физический контроль |
Контроль при отпуске |
||
Проверить этикетку
|
||||
Бесцветная прозрачная жидкость без запаха и механических включений |
(не проводится) |
15
Solutio Magnesii sulfatis 25 % 1000 мл (концентрированный раствор)
Работа с рецептом |
Письменный контроль |
Качественный контроль |
Количественный контроль |
Оформление результатов |
(не проводится) |
|
|||
|
Проверить запись в лабораторно-фасовочном журнале Магния сульфата Воды очищенной Раствор магния сульфата 25 % – 1 л
|
Провести качественные реакции на Mg2+
1.Mg2+
+ Na2HPO4
+ NH4OH
MgNH4PO4 + 3CH3COOH → Mg(CH3COO)2 + CH3COONH4 + H3PO4
на SO42-: HCL 1.SO42+BaCl2→BaSO4↓+2Cl– белый осадок, нерастворимый в щелочах и кислотах |
Провести количественное определение методом рефрактометрии
н.о.
F25% MgSO4 = 0,00089
Расчет по формуле: n - n0 C %= -----------, F
|
Оформить результаты анализа в журнале
|
Органолептический контроль |
Физический контроль |
Контроль при отпуске |
||
Проверить этикетку
|
||||
|
(не проводится) |
16
Solutio Protargoli 2 % 10 ml № 20 M.D.S. Капли в нос (внутриаптечная заготовка и фасовка)
Работа с рецептом |
Письменный контроль |
Качественный контроль |
Количественный контроль |
Оформление результатов |
|
|
|||
(не проводится) |
Проверить запись в лабораторно-фасовочном журнале Протаргола 4,0 Воды очищенной 200 мл Раствор протаргола 2 % 10 мл – 20 фл
|
Провести качественную реакцию на протаргол (белок) 0,5 мл раствора прибавить 3 капли раствора HCl, нагреть до кипения, осадок отфильтровать. К фильтрату прибавляют 5 капель NaOH и 1 каплю CuSO4 – образуется фиолетовое окрашивание
|
Количественное определение провести методом роданометрии Химизм метода
Ag2O + 2HNO3 = 2AgNO3 + H2O AgNO3 + NH4CNS = AgCNS↓ + NH4NO3 FeNH4(SO4)2 + 3NH4CNS = Fe(CNS)3 + 2(NH4)2SO4 УЧ Ag = 1; М. м.Ag = 107,9
0,00216 * 100 Т0,02 М NH4CNS/протаргол= -------------------- = 8 =0,02700 г/мл
н.о. ± 4 % 3,84–4,16
Рассчитать объем титранта на 1 мл раствора
Vmin
=
Vmax
=
Методика К 1 мл раствора прибавляют 0,5 мл раствора азотной кислоты до обесцвечивания и 3 капли раствора железо-аммонийных квасцов, титруют 0,02 М NH4CNS до желтовато-розового окрашивания раствора Расчет по формуле:
VNH4CNS * k*T*200 m =---------------------------- a
|
Оформить результаты анализа в журнале В лабораторно-фасовочном журнале поставить № анализа и расписаться
|
Органолептический контроль |
Физический контроль |
Контроль при отпуске |
||
Основная этикетка «Наружное» Sol. Protargoli 2 % – 10 мл Дата приготовления № серии Дополнительная этикетка «Хранить в темном прохладном месте» «Перед употреблением взбалтывать» Поставить на этикетке № анализа
1 17 |
||||
Жидкость бурого цвета со специфическим запахом |
Vфасовки = 10мл;
н.о. ± 10 % 9–11 мл
Количество флаконов – 20
|
18
Семинар №4
“Лекарственные средства, производные элементов 1, 2 групп ПСЭ”
1. Общая характеристика элементов (расположение в ПСЭ, строение атомов, степень окисления, соединения элементов). Биологическая роль и медицинское использование их соединений.
Mg, Ca, Zn, Ag
2. Провести фармакопейный анализ препаратов (латинское название, строение препарата, получение, описание, подлинность, чистота, количественное определение, хранение, применение):
Магния сульфат;
Кальция хлорид;
Цинка сульфат;
Серебра нитрат, протаргол, колларгол
3. Провести внутриаптечный анализ лекарственных форм:
Раствор кальция хлорида 50% (1:2) – 1 л
Раствор магния сульфата 25% (1:4) – 2 л
Раствор кальция хлорида 5% - 100 мл № 50
Rp: Раствора цинка сульфата 0,25% - 20 мл
Кислоты борной 0,2
D.t.d.№100
S. Глазные капли
Раствор протаргола 2 % - 10 мл №20 (капли в нос)
Раствор колларгола 1% - 25 мл №10 (глазные капли)
Rp: Раствора кальция хлорида 25% - 100 мл
Кислоты аскорбиновой 1,0
19
M.D.S. По 1 дес. ложке 3 раза в день
Обобщающий тест «Неорганические лекарственные средства»
Индикатор аргентометрического титрования по методу Мора:
А. дифенилкарбазон
Б. эозинат натрия
В. хромат калия
2. Цвет окраски надхромовой кислоты в эфире:
А. зеленый Б . Синий В. Желтый 3. Качественная реакция по ГФ XI на катион магния: А. Mg SO4 + 2 NH4OH → Mg (OH )2↓ + (NH4)2 SO4 Б. Mg SO4 + Ba Cl2 → Ba SO4↓ + Mg Cl2 В. Mg SO4 + Na2HPO4 + NH4OH → Mg NH4 PO4↓ + Na2 SO4 + H2O 4. Хлорамин в кислой среде окисляет до свободного галогена: А. Na I
Б. NaCl В. NaBr
5. Тиосульфат - ион открывают с реактивами: А. AgNOз Б. (NH4)2 C2O4 В. НCl 6. Установить соответствие с одним правильным ответом между галидом серебра и растворимостью в растворе аммиака 1. Ag I А.Растворим 2. Ag Br Б.Нерастворим 3. Ag Cl В.Частично растворим 7. Установите соответствие между лекарственным средством и методом количественного определения. 1. кальция хлорид А. роданометрия 2. серебра нитрат Б.трилонометрия,аргентометрия,меркуриметрия, ж меркурометрия 3. цинка сульфат В.Трилонометрия
8.Установите соответствие между анионом и цветом хлороформного слоя при проведении реакции с сильным окислителем в кислой среде.
1.Br - А.синий 2. I - Б.зеленый В.Красно-фиолетовый
Г.желто-бурый
9. Установите соответствие между уравнениями реакций и цветом образующегося осадка
1. AgNO3 + NaJ → Ag I↓ + Na NO3 А.Желтый
2. AgNO3 + NaBr → Ag Br↓ + Na NO3 Б.светло-желтый 3. AgNO3 + NaCl → Ag Cl↓+ Na NO3 В.белый
10. Методы количественного определения для анализа концентрированного раствора натрия бромида 1:5: А. Аргентометрия, рефрактометрия Б. Алкалиметрия, аргентометрия В. Перманганатометрия Г. Аргентометрия, перманганатометрия
20
Контрольная работа №1
“ОБЩАЯ ФАРМАЦЕВТИЧЕСКАЯ ХИМИЯ.
НЕОРГАНИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА”
1.Предмет и содержание фармацевтической химии. Современные проблемы и перспективы развития фармацевтической химии.
2.Государственная система контроля качества лекарственных средств.
3.Внутриаптечный контроль качества лекарственных форм, предупредительные мероприятия, оценка качества лекарственных средств, приготовляемых в аптеке. Виды внутриаптечного контроля. Внутриаптечный контроль различной продукции.
4.Неорганические лекарственные средства. Общая характеристика элементов (расположение в ПСЭ, строение атомов, степень окисления, соединения элементов). Биологическая роль и медицинское использование их соединений.
7 гр ПСЭ - Cl, Br, Y
6 гр ПСЭ - O, S
4, 3 гр ПСЭ - С, В
2, 1 гр ПСЭ - Mg, Ca, Zn, Ag
5.Фармакопейный анализ препаратов (латинское название, строение препарата, получение, описание, подлинность, чистота, количественное определение, хранение, применение):
Кислота хлороводородная;
Натрия и калия хлорид;
Натрия и калия бромид;
Натрия и калия йодид;
Йод, раствор йода 5%, 10%
Вода очищенная, вода для инъекций;
Натрия тиосульфат;
Натрия гидрокарбонат;
Кислота борная;
Натрия тетраборат;
Магния сульфат;
Кальция хлорид;
Цинка сульфат;
Серебра нитрат;
Протаргол, колларгол.
6.Внутриаптечный контроль качества лекарственных форм;
Вода очищенная, вода для инъекций
Концентрированные растворы
Внутриаптечная заготовка и фасовка
Растворы для наружного применения
Растворы для внутреннего применения
21
Качественные реакции на функциональные группы

 =
0,04393г/мл
=
0,04393г/мл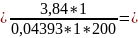 0,44
мл
0,44
мл =0,47 мл
=0,47 мл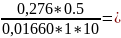 0,83
мл
0,83
мл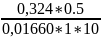 = 0,98 мл
= 0,98 мл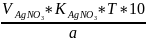
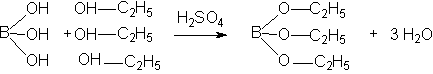
 0,49 мл
0,49 мл 0,55 мл
0,55 мл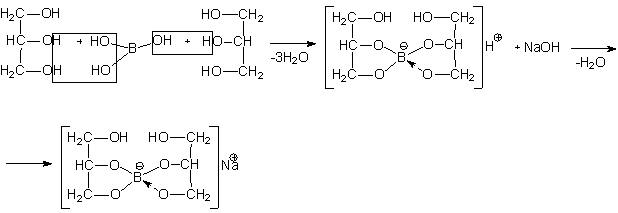 УЧ
H3BO3
=
1; Т 0,1
М NaOH/H3BO3
= 0,006183 г/мл
УЧ
H3BO3
=
1; Т 0,1
М NaOH/H3BO3
= 0,006183 г/мл 0,71 мл
0,71 мл = 0,77 мл
= 0,77 мл