
- •Хімія група 2-а Тема уроку: Явище ізомерії. Структурна ізомерія, номенклатура насичених вуглеводів
- •1. Поняття «ізомерія»: визначення, приклади ізомерів
- •3. Поняття «радикали», назви радикалів
- •Назви одновалентних радикалів насичених вуглеводнів
- •4. Правила складання назв ізомерів
- •Хід роботи
- •Урок 3 Багатоманітність органічних сполук, їхня класифікація
- •1. Розподіл органічних сполук на класи
- •2. Поняття «гомологи» та «гомологічні ряди»
- •3. Циклічні та ациклічні органічні сполуки
- •4. Оксигеновмісні органічні сполуки. Поняття «функціональна група»
- •5. Нітрогеновмісні сполуки
- •Урок 4 Органічні речовини в живій природі. Рівні структурної організації органічних речовин
- •1. Основні органічні речовини, що містяться у складі живих організмів
- •Вуглеводи
- •Нуклеїнові кислоти
- •2. Функції органічних речовин у живих організмах Функції білків
- •Функції жирів
- •Функції вуглеводів
- •3. Структурна організація білків
- •4. Гідроліз і денатурація білків
- •5. Структурна організація вуглеводів
- •6. Жири і жироподібні речовини, їхні хімічні особливості
- •7. Нуклеїнові кислоти
- •8. Перехід від молекулярного рівня організації до рівня органел, клітини й організму в цілому
Хімія група 2-а Тема уроку: Явище ізомерії. Структурна ізомерія, номенклатура насичених вуглеводів
План вивчення нового матеріалу
1. Поняття «ізомерія»: визначення, приклади ізомерів.
2. Складання структурних формул ізомерів на прикладі бутану, пентану.
3. Поняття «радикали»: визначення, назви радикалів
4. Правила складання назв ізомерів.
5. Складання формул речовин за назвами.
Завдання
Складіть структурні формули речовин: 2-метилпропан, 2-метилпентан, 3-метилпентан, 3,3-диметилпентан.
6.1. Лабораторний дослід № 1. Виготовлення моделей парафінів.
6.2. Робота за картками. (Індивідуальне письмове завдання.)
1. Поняття «ізомерія»: визначення, приклади ізомерів
Сполуки, що мають однакові молекулярні формули, але різну будову і різні властивості, називають ізомерами. Явище існування таких сполук називається ізомерією.
Хімічну будову речовини можна зобразити за допомогою структурних формул, які показують послідовність зв’язків між атомами в молекулі.
Наприклад:
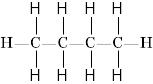
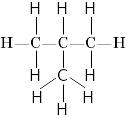
Бутан 2-метилпропан (ізобутан)
Ці дві різні структурні формули мають однаковий молекулярний склад C4H10.
Як порахувати кількість ізомерів для певної органічної сполуки?
Кількість можливих ізомерів у насичених вуглеводнів (алканів) вражає навіть спокушену уяву:
Формула |
Назва |
Число ізомерів |
|
Метан |
1 |
|
Етан |
1 |
|
Пропан |
1 |
|
Бутан |
2 |
|
Пентан |
3 |
|
Гексан |
5 |
|
Гептан |
9 |
|
Октан |
18 |
|
Нонан |
35 |
|
Декан |
75 |
|
Ундекан |
159 |
|
Додекан |
355 |
|
Тридекан |
802 |
|
Тетрадекан |
1858 |
|
Пентадекан |
4347 |
|
Ейкозан |
336 319 |
|
Пентакозан |
36 797 588 |
|
Триаконтан |
4 111 846 763 |
|
Тетраконтан |
62 481 801 147 341 |
|
Гектан |
близько
|
Починаючи з C167H336, число ізомерів уже перевищує число елементарних часток у видимій частині Всесвіту, що оцінюється як 1080. Так, у C200H402 може бути до 9,430.1083 ізомерів. А якщо враховувати ще й дзеркально-симетричні молекули — стереоізомери, ці числа значно зростуть: з 9 до 11 для гептану, з 75 до 136 для декану, з 336 319 до 3 396 844 для ейкозану, з 5,921.1039 до 1,373.1046 для гектану й т. д. Вуглеводень із самим довгим ланцюгом — нонаконтатриктан C390H782 синтезували в 1985 р. англійські хіміки Бідд і Уайтинг.
Не одне покоління школярів і студентів пильно розглядало подібні таблиці в підручниках з органічної хімії, проте помітити певну закономірність у цифрах не вдавалося.
Першим цю проблему вирішив англійський математик Артур Келлі, один із засновників топології. Виявилося, що формули, за якої можна відразу визначити число ізомерів для вуглеводню складу CnH2n+2, взагалі не існує. Є тільки так звані рекурентні (від латин. Recurrens — повернення) формули, які дозволяють розрахувати число ізомерів n-го члена ряду, якщо відоме число ізомерів (n-1)-го члена. Розрахунки для великих значень n, виконані порівняно недавно за допомогою потужних комп’ютерів і проведені до вуглеводню C400H802, для якого отримане значення числа ізомерів, з урахуванням стереоізомерів, майже непідвласне уяві: 4,776.10199!
Для хіміків практичний інтерес представляє тільки число структурних ізомерів у перших членів ряду. Справа в тому, що навіть для порівняно простого алкану, що містить усього півтора десятка атомів Карбону, переважна більшість ізомерів не одержана на практиці, і навряд чи це коли-небудь відбудеться. Так, останні з 75 ізомерів декану синтезовані лише до 1968 р. і зроблено це було тільки для того, щоб мати більш повний набір стандартних сполук, за якими можна розпізнати різні вуглеводні, наприклад ті, що містяться в нафті. (До речі, у нафті були виявлені всі 18 ізомерів октану.)
Крім того, починаючи з гептадекану C17H36, спочатку лише деякі ізомери, а потім — багато хто з наведених у таблиці, а згодом — практично всі є яскравим прикладом «паперової хімії», тобто не можуть існувати в дійсності.
Справа в тому, що в міру зростання числа атомів Карбону в молекулах ізомерів «сферичної» форми ускладнюється їхнє розміщення в просторі при заміні атомів Гідрогену на метильні групи CH3. Адже математики розглядають атоми Карбону й Гідрогену як умовні крапки, а насправді вони мають кінцевий радіус. Уже на поверхні дуже розгалуженого ізомеру C17H36 для розміщення всіх 36 атомів Гідрогену в 12 метильних групах не вистачає місця. Це легко перевірити, якщо намалювати структуру ізомерів на площині, дотримуючи сталості довжин зв’язків C—C і C—H і всіх кутів між ними.
