
- •Классификация по агрегатному состоянию
- •Классификация по фазовой различимости
- •Значение современной коллоидной химии
- •Адсорбция
- •Фундаментальное адсорбционное уравнение Гиббса
- •Закон Генри
- •Теория адсорбции бэт
- •Уравнение бэт в линейном виде.
- •Влияние природы адсорбента и адсорбата. Хемосорбция
- •Капилярные явления
- •Термодинамические соотношения между σ и ϕ
- •Строение двойного электрического слоя
- •Представления Гельмгольца и Перрена.
- •Модель двойного слоя Гуи (1910 г.) и Чепмена (1913 г.).
- •Современная теория строения дэс основана на представлениях Штерна (1924 г.).
- •Строение и формула мицеллы
- •Строение мицеллы пав
- •Метод определения ккм
Адсорбция
Истинно коллоидные дисперсные системы в процессе своего образования термодинамически неустойчивы вследствие наличия большого запаса избыточной поверхностной энергии Gs=σ·S, которая самопроизвольно стремится уменьшиться, тем самым переводя систему в более устойчивое состояние. Понижение Gs возможно при уменьшении межфазной поверхности (при понижении дисперсности) или при понижении поверхностного натяжения σ. К поверхностным явлениям, происходящим вследствие стремления дисперсной системы к самопроизвольному снижению поверхностного натяжения, относится адсорбция. Это процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. Результатом такого перераспределения является сгущение одного или нескольких компонентов системы на границе раздела фаз. В этом случае компонент, который сгущается (адсорбируется) на поверхности, называется адсорбатом, а вещество, на поверхности которого идет адсорбция, называется адсорбентом.
Для количественного описания процесса адсорбции используется две величины, обозначаемые Г и А, имеющие одинаковую размерность [моль/м2] или [кг/м2] или [кг/кг], но разный смысл. А – величина абсолютной адсорбции; Г – величина гиббсовской адсорбции, т.е. избыток вещества в поверхностном слое по сравнению с его количеством в таком же объеме соответствующей фазы, отнесенный к единице поверхности или единице массы адсорбента. Т.о. Г – величина избыточная.
Фундаментальное адсорбционное уравнение Гиббса
В результате адсорбции происходит перераспределение компонентов между объемом и поверхностным слоем, что влечет за собой изменение их химических потенциалов в системе, потому этот процесс можно рассматривать как превращение свободной избыточной энергии в энергию химическую. Введем соотношение между σ и μ.
На основе объединенного уравнения 1 и 2 начал термодинамики запишем:

Поскольку внутренняя энергия поверхности пропорциональна экстенсивным величинам, то:

или полный дифференциал

отсюда

При T – const


где
 , поверхностный избыток i
компонента в поверхностном слое по
сравнению с его равновесной концентрацией
в объемной фазе.
, поверхностный избыток i
компонента в поверхностном слое по
сравнению с его равновесной концентрацией
в объемной фазе.

Это и есть фундаментальное адсорбционное уравнение Гиббса
Для одного компонента уравнение примет вид:

Принимая
во внимание, что
 и
и
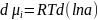 ,
получим
,
получим
 ,
а
,
а

Таким
образом
 ,
для разбавленных растворов
,
для разбавленных растворов

и
 .
Для адсорбции из газовой фазы
.
Для адсорбции из газовой фазы
 ,
если
,
если
 .
.
Зная
зависимость
 и
и
 можно рассчитать изотерму гиббсовской
адсорбции этого компонента.
можно рассчитать изотерму гиббсовской
адсорбции этого компонента.
В
лабораторной работе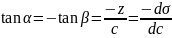 , тогда
, тогда
 .
.
 ,
,
 ,
,
 .
.
Изотерма поверхностного натяжения Изотерма адсорбции


Производная
 отражает влияние природы вещества на
адсорбцию. Она определяет и знак
гиббсовской адсорбции. Эта величина
называется поверхностной активностью
(по Ребиндеру)
отражает влияние природы вещества на
адсорбцию. Она определяет и знак
гиббсовской адсорбции. Эта величина
называется поверхностной активностью
(по Ребиндеру)
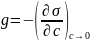 .
Графически это
.
Графически это
 наклона касательной, проведенной в
точку А изотермы σ.
наклона касательной, проведенной в
точку А изотермы σ.
g
является важной адсорбционной
характеристикой веществ и имеет
размерность
 или
или
 .
.
Физический смысл [g] – это сила, удерживающая вещество на поверхности и рассчитанная на единицу гиббсовской адсорбции.
Если g > 0, то Г > 0 – адсорбция положительная и вещество поверхностно-активное [ПАВ]; в противном случае оно поверхносто-инактивное [ПИВ].
Термин
ПАВ применяют к спецефическим веществам
с большой g
по отношению к воде. Молекулы ПАВ имеют
неполярную углеводородную цепочку и
полярную функциональную группу: –COOH,
–NH2,
–OH
и т.д. Условно
![]() .
Неполярные радикалы вытягиваются из
полярного растворителя (H2O)
на поверхность. Концентрация ПАВ в
поверхностном слое обычно на 4-5 порядков
выше, чем в объемной фазе. Правило
Дюкло-Траубе: при удлинении углеводородного
радикала на группу –CH2
(g)
вещества увеличивается ~ в 3,2 раза.
.
Неполярные радикалы вытягиваются из
полярного растворителя (H2O)
на поверхность. Концентрация ПАВ в
поверхностном слое обычно на 4-5 порядков
выше, чем в объемной фазе. Правило
Дюкло-Траубе: при удлинении углеводородного
радикала на группу –CH2
(g)
вещества увеличивается ~ в 3,2 раза.
Примером ПИВ по отношению к воде являются неорганические соли.
Примером истинных ПАВ: мыла (олеат натрия), стиральные порошки и другие моющие средства.
