
- •Классификация по агрегатному состоянию
- •Классификация по фазовой различимости
- •Значение современной коллоидной химии
- •Адсорбция
- •Фундаментальное адсорбционное уравнение Гиббса
- •Закон Генри
- •Теория адсорбции бэт
- •Уравнение бэт в линейном виде.
- •Влияние природы адсорбента и адсорбата. Хемосорбция
- •Капилярные явления
- •Термодинамические соотношения между σ и ϕ
- •Строение двойного электрического слоя
- •Представления Гельмгольца и Перрена.
- •Модель двойного слоя Гуи (1910 г.) и Чепмена (1913 г.).
- •Современная теория строения дэс основана на представлениях Штерна (1924 г.).
- •Строение и формула мицеллы
- •Строение мицеллы пав
- •Метод определения ккм
Оглавление
стр.
Лекция 1. Введение 4
Лекция 2. Поверхностные явления 10
Лекция 3. Теория адсорбции Ленгмюра 16
Лекция 4. Адсорбция ПАВ и полимеров 21
Лекция 5. Адгезия, смачивание и растекание жидкостей 23
Лекция 6. Электроповерхностные явления 30
ЛЕКЦИЯ 1
Литература:
Фролов Юрий Геннадьевич, Курс коллоидной химии. Поверхностные явления и дисперсные системы.
Фридрихсберг Дмитрий Александрович, Курс коллоидной химии.
Воюцкий Сергей Сергеевич, Курс коллоидной химии.
Лабораторные работы и задачи по коллоидной химии, под редакцией Фролова Ю.Г. и Гродского А.С.
Введение
По Фридрихсбергу: «Современная коллоидная химия это наука о высокораздробленном состоянии вещества, наука о поверхностях и коллоидах».
Слово коллоид происходит от греческих æολλα – клей, ειδοσ – вид (т.е. клеевидный).
По Фролову: «Коллоидная химия это наука о поверхностных явлениях и дисперсных системах. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазовом поверхностном слое».
Основной коллоидно-химической характеристикой является дисперсность, т.е. рассеянность, раздробленность вещества. В коллоидной химии понятие дисперсности простирается на широкую область размеров тел: от больших, чем простые молекулы, до видимых невооруженным глазом, т.е. от 10-9 до 10-4 м или от 1 нм до 100 мкм. Дисперсионная система в простейшем случае представляет собой дисперсную фазу, распределенную в дисперсной среде. Дисперсные системы с одинаковыми по размеру частицами называются монодисперсными, а с неодинаковыми – полидисперсными.
Коллоидное состояние – это всеобщее особое состояние материи, основными признаками которого являются дисперсность и гетерогенность. Дисперсные системы гетерогенны. Дробя и умельчая любое тело, мы непрерывно увеличиваем его суммарную поверхность, сохраняя неизменным его объем и массу. Т.о. по мере роста дисперсности (раздробленности) увеличивается удельная поверхность, т.е. поверхность приходящаяся на единицу массы или объема, достигает весьма больших значений.
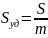 или
или
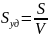 или
или
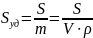
Для
кубика:
 ,
где l
– длина ребра.
,
где l
– длина ребра.
Для
шарика:
 ,
где d
– линейный размер.
,
где d
– линейный размер.
В
общем случае:
 ,
где R
– коэффициент формы частицы, α
– линейный размер, D
– дисперсность, величина, обратная
линейному размеру [м-1].
,
где R
– коэффициент формы частицы, α
– линейный размер, D
– дисперсность, величина, обратная
линейному размеру [м-1].
Увеличение Sуд проиллюстрируем на примере дробления кубика с длиной ребра в 1 см.
Длина ребра дробных частиц l, см |
Число частиц |
Sуд, см-1 |
1 |
1 |
6 |
10-1 (1 мм) |
103 |
6·10 |
10-4 (1 мкм) |
1012 |
6·104 |
10-7 (1 нм) |
1021 |
6·107 = 6000 м2/ 1 см3 |
По мере дробления вещества происходит переход количественных изменений к возникновению нового качества. Наряду с изменением свойств веществ, характерных для обычного состояния, появляются и новые, присущие состоянию коллоидному. Реальный окружающий нас мир, как и мы сами, состоит из дисперсных систем, поэтому коллоидную химию можно назвать химией реальных тел. По образному выражению Пескова: «Человек – это движущийся коллоид».
Чем
же объясняется своеобразие свойств
вещества в коллоидном состоянии? Прежде
всего тем, что в этом состоянии значительная
доля от всех молекул или атомов,
составляющих вещество, находится на
поверхности раздела фаз. Эти молекулы
являются «особенными» по своему
энергетическому состоянию, они обладают
избыточной свободной энергией. Например,
для частиц кубической формы с длиной
ребра l
= 10-6м,
на котором помещается ≈
5000 молекул (считая размер 1 молекулы в
2·10-10м
или в 2 )
доля поверхностных из них, т.е. «особенных»
составляет ~0,1%.
)
доля поверхностных из них, т.е. «особенных»
составляет ~0,1%.
Число молекул на длине ребра n = 10-6/2·10-10=5000 молекул. Поверхностных молекул в кубике: Sмол = 6·5000·5000=150·106 молекул, а в объеме кубика Vмол= 5000·5000·5000=125·109молекул, тогда доля поверхностных молекул составит Sмол/Vмол = 150·106/125·109 ≈1·10-3 или ≈0,1%.
Д ля
частиц с длиной ребра 2 нм, на котором
помещается 10 молекул, доля поверхностных
из них составляет:
ля
частиц с длиной ребра 2 нм, на котором
помещается 10 молекул, доля поверхностных
из них составляет:
 или 60%.
или 60%.
Т.о. во сколько раз уменьшается длина ребра кубической частицы, во столько же раз увеличивается доля поверхностных молекул относительно их общего количества в этой частице. Последнее обстоятельство составляет основную и важнейшую особенность коллоидного состояния: значительная доля всей свободной энергии системы сосредоточена в межфазных поверхностных слоях, что является причиной возникновения явлений, получивших название поверхностных.
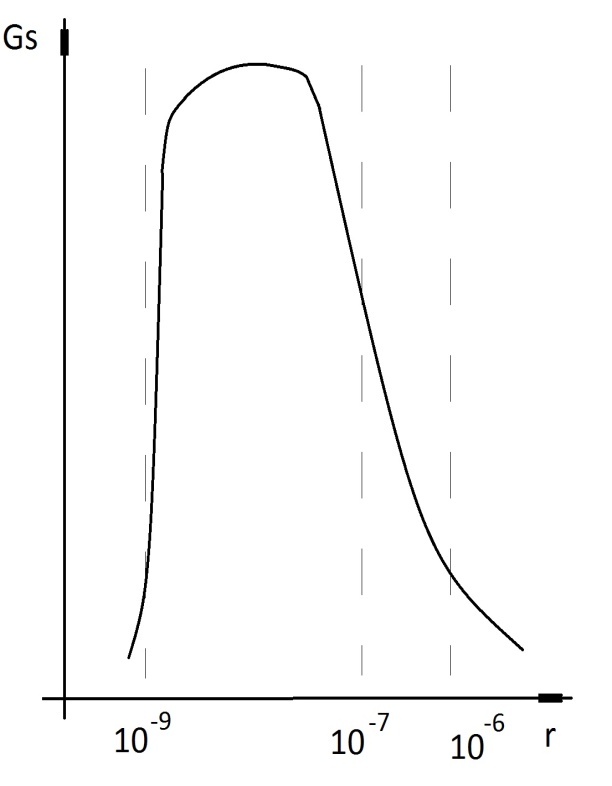 На
рис. показано изменение свободной
поверхностной энергии Gs
системы по мере дробления (диспергирования)
ее частиц. Неограниченное диспергирование
гетерогенной системы переводит ее в
гомогенный молекулярный раствор. Этот
переход сочетает в себе единство
непрерывности и скачка, т.е. переход
количественных изменений в качественные.
Границы области коллоидного состояния
≈1~100
нм, хотя коллоидная химия изучает и
более крупные объекты, поскольку в них
обнаруживаются признаки, присущие
коллоидным системам.
На
рис. показано изменение свободной
поверхностной энергии Gs
системы по мере дробления (диспергирования)
ее частиц. Неограниченное диспергирование
гетерогенной системы переводит ее в
гомогенный молекулярный раствор. Этот
переход сочетает в себе единство
непрерывности и скачка, т.е. переход
количественных изменений в качественные.
Границы области коллоидного состояния
≈1~100
нм, хотя коллоидная химия изучает и
более крупные объекты, поскольку в них
обнаруживаются признаки, присущие
коллоидным системам.
Классификация дисперсных систем.
Известно что только совокупность проекций дает правильное представление об объемном теле. Так и в коллоидной химии, включающей многообразие свойств дисперсных систем, нет единой исчерпывающей классификации. Они как проекции оттеняют все многообразие этой науки.
Классификация по дисперсности (по размеру частиц)
Грубодисперсные с размерами частиц 10-4~10-6 м;
1 Å = 10-10м (размер молекул);
1 нм = 10-9м; 1 мкм = 10-6м; 1 мм = 10-3м.
Микрогетерогенные с размерами 10-6~10-7м.
Ультрамикрогетерогенные или истинно коллоидные с размерами частиц 10-7~10-9м.
Частица наименьших размеров состоит из нескольких молекул (5-10).
В общем случае высокодисперсные системы называются золями. Различают гидро-, органо- и аэрозоли.
Грубодисперсные системы неустойчивы: они оседают или всплывают в гравитационном поле; не проходят через бумажный фильтр и видимы глазом или в обычный микроскоп. Это суспензии, эмульсии, взвеси.
Высокодисперсные системы практически не оседают и не всплывают, задерживаются только ультрафильтрами (целлофан, пергамент) и невидимы в оптический микроскоп.
Отметим, что система приобретает коллоидные свойства даже тогда, когда хотя бы одно из трех измерений находится в указанной области высокой дисперсности. Это двумерно и одномернопротяженные системы; в связи с чем различают системы корпускулярные, фибриллярные и ламелярные. Например живые клетки, вирусы, нервы, мышцы, волокна, мембраны, пленки, фольги, асбест, бумага и т.д.
Приведем размеры частиц некоторых корпускулярных систем:
грунты песчаные свыше 50 мкм
грунт планеты Венера 0,1 – 10 мкм
эритроциты крови до 7 мкм
мутная вода 10 – 100 нм
дым сигареты 30 – 40 нм
золь золота 20 нм
поры активированного угля 1 – 10 нм
вирус гриппа 0,1 – 100 нм
Классификация по агрегатному состоянию
Существует 8 типов дисперсных систем, благодаря различным сочетаниям агрегатных состояний дисперсной фазы и дисперсионной среды и только газ в газе не образует подобной гетерогенной системы, хотя в атмосфере Земли и наблюдаются флуктуации плотности различных газов, но они короткоживущие, да и различия в плотностях не столь велики. Все это не позволяет создать сколь-нибудь устойчивую дисперсионную систему (гетерогенную) газ в газе.
№ п.п. |
дисп. фаза / дисп. среда |
условн. обозн. |
тип системы |
Примеры |
1 |
твердое/жидкость |
т/ж |
золи, суспензии |
Илы, краски, взвеси, пульпы, пасты, золи металлов, бактерии и вирусы |
2 |
жидкость/жидкость |
ж/ж |
эмульсии, органозоли |
Смазки, нефть, молоко, вода-масло (сожи), кремы, вина, сливочное масло, майонез |
3 |
газ/жидкость |
г/ж |
пены |
Флотацинные, мыльные, пивные пены, шампанское. |
4 |
твердое/твердое |
т/т |
сплавы, твердые золи |
Цветные стекла, пластмассы, сталь, чугун, бетон, самоцветы, керамика, минералы, ситаллы |
5 |
жидкость/твердое |
ж/т |
твердые эмульсии, гели, капиллярные системы |
Адсорбенты в растворах, почвы, грунты, опал, холодец, жемчуг, перламутр |
6 |
газ/твердое |
г/т |
твердые пены, пористые и капиллярные системы |
Катализаторы в газах, активированный уголь, силикагель, пемза, пенопласт, пенобетон |
7 |
твердое/газ |
т/г |
аэрозоли |
дымы, пыли, порошки, пудра |
8 |
жидкость/газ |
ж/г |
аэрозоли |
тучи, туманы, облака, дезодоранты |
Классификация по структуре
Все дисперсные системы можно разделить на два класса: свободнодисперсные, в которых частицы свободно перемещаются друг относительно друга (золи, эмульсии), и связнодисперсные, в которых одна из фаз структурно закреплена (мембраны, капиллярные системы, гели, студни, пены, твердые растворы).
Классификация по межфазному взаимодействию
Различают лиофильное и лиофобное взаимодействие. Взаимодействие между веществами дисперсной фазы и дисперсионной среды за счет межмолекулярных сил на границе раздела фаз протекает всегда, но степень его проявления может быть различной. Лиофильное взаимодействие является сильным («любящее» растворение), лиофобное взаимодействие слабое («боящееся» растворения). Лиофильные коллоиды после выпадения в осадок могут быть снова переведены в раствор добавлением растворителя (белок, желатин и др.). Лиофобные коллоиды выпадают в осадок необратимо.
Мыла и многие глины самопроизвольно «распускаются» в воде, а ВМС растворяются в «хорошем» растворителе до отдельных молекул – все это характерно для лиофильных систем.
Классификация по фазовой различимости
Растворы ВМС занимают особое место в коллоидно-химической классификации. Являясь, по существу, истинными, они обладают в тоже время многими признаками коллоидного состояния. Размеры макромолекул являются соизмеримыми с размерами коллоидных частиц. Поскольку растворы ВМС диалектически сочетают свойства молекулярных растворов и коллоидных систем, целесообразно назвать их молекулярными коллоидами, в отличии от типичных высокодисперсных систем, называемых суспензиями.
Коллоидная химия изучает свойства высокодисперсных систем на основе поверхностных явлений, а также физико-химические свойства ВМС и их растворов.
