
- •7. Концентрації розчинів.
- •8.Розчинність твердих, рідких та газоподібних речовин. Закон Генрі.
- •9.Осмос.Закон Вант-Гоффа.
- •10.Закони Рауля.
- •11.Теорія електролітичної дисоціації. Константа і ступінь дисоціації електролітів.
- •12.Сильні та слабкі електроліти. Закон розведення Освальда.
- •13.Класи неорганічних сполук з
- •14.Іонний добуток води. Водневий показник рН. Добуток розчинності.
- •42.Елементи viа групи. Халькогени
- •43.Фізичні властивості
- •Хімічні властивості
- •Титрування та його види
Титрування та його види
Процес додавання одного розчину до іншого до досягнення точки еквівалентності з метою визначення концентрації одного з них називається титруванням.
Розрізняють пряме і зворотне титрування. При прямому титруванні досліджуваний розчин безпосередньо титрують стандартним розчином. Зворотне титрування застосовують тоді, коли досліджувана речовина не реагує зі стандартним розчином або реагує повільно. В цьому випадку до розчину приливають надлишок третього компонента і відтитровують стандартним розчином.
Момент закінчення реакції, коли реагуючі речовини повністю прореагують називаються точкою еквівалентності.
Методом
нейтралізації називається метод
титриметричного аналізу, який ґрунтується
на використанні реакції взаємодії йонів
гідрогену і гідроксогрупи:
 Оксидиметрія
ґрунтується на використанні окисно-відновних
реакцій.
Оксидиметрія
ґрунтується на використанні окисно-відновних
реакцій.
Робочими розчинами в оксидиметрії є розчини окисників і відновників. Кількісною характеристикою інтенсивності окисно-відновного процесу є різниця окисно-відновних потенціалів реагуючих між собою систем.
57.Ацидиме́трія — метод об'ємного
аналізу,
що сводиться до визначення
вмісту кислот у розчинах за
відомою концентрацією лугу.
Робочтй розчин-HCl,
аналізований
розчин-КОН (NaOH).
Індикатор: метилоранж в точці
еквівалентності змінюється з жовтого
на рожевий. (HCl+KOH=NaCl+H20)…
Результати обчислюємо на основі закону
еквівалентів: N(HCl)*V(HCl)=N(KOH)*V(KOH)….Нормальность
КОН визначаємо за формулою N(KOH)=
 …Маса m(KOH)=N(KOH)*Meквіваленту(КОН)*V(KOH)…
Використання в практиці СГ: Протолітометрія
використовують з метою визначення
кислотності молока та хліба, кислотності
меду; Для встановлення карбонатної
твердості води. Для визначення нітрогену
в солях амонію; для визначення загальної
кислотності плодів та овочів.
…Маса m(KOH)=N(KOH)*Meквіваленту(КОН)*V(KOH)…
Використання в практиці СГ: Протолітометрія
використовують з метою визначення
кислотності молока та хліба, кислотності
меду; Для встановлення карбонатної
твердості води. Для визначення нітрогену
в солях амонію; для визначення загальної
кислотності плодів та овочів.
58.
Комплексомитрія-грунтується на утворенні
комплексних сполук. Комплексні сполуки
утворюються між індикатором та
аналізованою речовиною. В процесі
титрування цей, комплекс руйнується і
утворюється більш міцний безбарвний
комплекс між аналізованою речовиною і
титрованим розчином (робочим розчином).
Визначення загальної твердості води
(Н2О). Робочий розчин трилон Б. Аналізований
розчин Н2О, що містить катіони  .
Індикатор: хромоген чорний, змінює своє
забарвлення в точці еквівалентності з
вино – червоного на синє. Трилон Б-є
етилендіамін тетраацетатна кислота
або натрієва силь. Рівняння реакції
індикатором:
.
Індикатор: хромоген чорний, змінює своє
забарвлення в точці еквівалентності з
вино – червоного на синє. Трилон Б-є
етилендіамін тетраацетатна кислота
або натрієва силь. Рівняння реакції
індикатором: 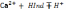 . Під час взаємодії Са з індикатором утв
комплекс вино – червоного кольору
Са
. Під час взаємодії Са з індикатором утв
комплекс вино – червоного кольору
Са +Na2[H2I]→Na2[CaI]+HI+
+Na2[H2I]→Na2[CaI]+HI+ …
Під час взаємодії Трилон Б з утвореним
комплексом, звільняється індикатор
синього кольору.
T=
…
Під час взаємодії Трилон Б з утвореним
комплексом, звільняється індикатор
синього кольору.
T=
 *1000
*1000
59.Перманганатометрія
як метод об’ємного аналізу.
Перманганатометрія визначення вмісту
Fe
в
розчині солі Мора. (NH4)2SO4*Fe2SO4*6H20
(сіль Мора, подвійна сіль амонійсульфата
і ферумсульфата на 6 молекул води).
Індикатор змінює забарвлення в точці
еквівалентності з блідо-рожевого, на
малиновий. KMnO4+FeSO4+H2SO4=MnSO4+K2SO4+Fe2(SO4)3+H2O…..
Cн(FeSO4)= ….
m(FeSO4)=Cн(FeSO4)*Mекв(FeSO4)*V(FeSO4)…
Використання перманганатометрії для
визначення вмісту оксалатної кислоти,
для визначення вмісту N
в азотних добривах.
….
m(FeSO4)=Cн(FeSO4)*Mекв(FeSO4)*V(FeSO4)…
Використання перманганатометрії для
визначення вмісту оксалатної кислоти,
для визначення вмісту N
в азотних добривах.
60.
Йодометрія, як метод об’ємного аналізу.
I2+2e= …
Визначення вмісту Сu
в розчині за йодометрією. Na2S2O3-
робочий розчин ( натрій тіосульфат).
CuSO4
–аналізований розчин. Індикатор:
крохмаль змінює свій колір з синього
на соломино-жовтий в точці еквівалентності.
Данний метод представляє собою, метод
заміщення. Тобто кількість еквівалентів
Cu,
дорівнює кількості еквівалентів
виділеного I,
а також кількості еквівалентів робочого
розчину натрій тіосульфат. Основний
процес титрування складається з двох
реакцій: допоміжної та основної.
2CuSO4+4KI=2CuI+I2+2K2SO4
– допоміжна реакція. 2Na2S2O3+I2=2NaI+Na2S4O6
– основна реакція. Результати аналізу
CuSO4-
досліджуваний розчин. Сн= ;
m(CuSO4)=Cн(CuSO4)*Mекв(CuSO4)*V(CuSO4)
Використання методу в практиці СГ: 1)Для
визначення вмісту Cu
в отрутохімікатах; 2) для визначення
вмісту активного Cl
в вапні ( білильному); 3) ) для визначення
якості олійних культур.
…
Визначення вмісту Сu
в розчині за йодометрією. Na2S2O3-
робочий розчин ( натрій тіосульфат).
CuSO4
–аналізований розчин. Індикатор:
крохмаль змінює свій колір з синього
на соломино-жовтий в точці еквівалентності.
Данний метод представляє собою, метод
заміщення. Тобто кількість еквівалентів
Cu,
дорівнює кількості еквівалентів
виділеного I,
а також кількості еквівалентів робочого
розчину натрій тіосульфат. Основний
процес титрування складається з двох
реакцій: допоміжної та основної.
2CuSO4+4KI=2CuI+I2+2K2SO4
– допоміжна реакція. 2Na2S2O3+I2=2NaI+Na2S4O6
– основна реакція. Результати аналізу
CuSO4-
досліджуваний розчин. Сн= ;
m(CuSO4)=Cн(CuSO4)*Mекв(CuSO4)*V(CuSO4)
Використання методу в практиці СГ: 1)Для
визначення вмісту Cu
в отрутохімікатах; 2) для визначення
вмісту активного Cl
в вапні ( білильному); 3) ) для визначення
якості олійних культур.
