
- •1.Қатты дене
- •2. Сұйық дене
- •3.Газ тәрізді дене
- •1.2. Механикалық кернеуден болатын деформация
- •1.3. Деформациялану жылдамдығы, ротор.
- •1.4. Механиканың бірыңғай ортасы үшін жалпы заңдылықтар мен теңдеулер
- •1.5 Тұтас орта термодинамикасының заңдары.
- •1.6 Гипстің тепе- теңдігі және диссипоция теңсіздігі
- •1.7 Онзагер принципі
- •1.8. Еркін (бос) энергия, энтальпия, Гиббстің термодинамикалық потенциалы
- •1.9. Тұтас ортаның кейбір математикалық моделі (үлгісі)
- •1.11. Ашық жүйелердің термодинамикасы
- •2.1. Адамның қарқынды қозғалмалы жүйесінің құрылымы
- •2. 5 Сурет. Бас сүйек жазықтығының сагиттальды иінтірегі [5]
- •2. 6 Сурет. Табан мен оған әсер ететін күштер бейнеленген.
- •2. 6 Сурет. Аяқтың ұшымен тұру [5]
- •2. 7 Сурет. Білек пен оған әсер ететін күштер бейнеленген.
- •2. 7 Сурет. Білек сүйектері, тіректі ұстап тұруы
- •2.2. Жердің ауырлық даласында екі аяқпен жүру кезінде дене массасының қозғалыс орталығы
- •2.8 Сурет. Масса орталығының бір қадамға өзгергендегі жүрген жолы
- •2. 3. Дөңгелек жүріс кезінде аяқтардың динамикасын теңестіру, қозғалыстың кезеңдері бойынша талдау
- •2.9 Сурет. Екі аяқты жүйенің моделі
- •2.4 Тұрақты әрекетсіз циркуль жүрісіне сипаттама
- •2.5 Бір периодтық жүріс кезіндегі төзімділік параметірлерін анықтау
- •2.14. Негізгі жалпы теория негізіндегі жүйенің биомеханикалық қозғалысы тепе-теңдікті қалыптастыру
- •2.15. Қозғалыс теңдеуін құратын көпзвеналық динамикалық жүйенің Лагранж формализмін қолдана отырып, деформацияланған элементтер құрылымы
- •2.16. Биомеханикалық бұрандама қозғалыс жүйесі бар, деформацияланған элемент құрылысының теңдеуі мен моделі
- •2.27 Сурет. Жазық қозғалысының бұрандама механикалық жүйесі мен бір тірек фазадағы өзгертілетін геометриялық буын моделі
- •2.17. Механикалық жүйелер элементтердің серпімді модулін анықтау
1.11. Ашық жүйелердің термодинамикасы
Ашық жүйелер ортамен энергия, зат, ақпарат алмасуымен сипатталады. Жабық жүйелер ортамен энергия ғана алмаса алады. Мынадай түсініктерді нақты ажырата білу қажет тұйық (толықтай оқшауланған), жабық (зат алмаса алмайтын) және ашық (энергия, зат, ақпарат алмаса алатын) жүйелер.
Термодинамикалық функциялар F– еркін энергия, U - ішкі энергия, S – энтропия, G - Гиббстың потенциалы ашық жүйелер үшін мағынасы бар деп болжамдайық:
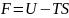
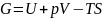 .
.
Ашық жүйе үшін dt уақыты ішінде z экстенсивті шаманың өзгерісін 2 түрлі қор негізінде қарастыруға болады. dez cжәне ыртқы факторлармен шартталған diz жүйенің ішкі қасиеттерімен байланысты, яғни
dZ =
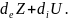 (1.91)
(1.91)
Ішкі энергияны к молярлық санының n құраушысы және энтропия S қолдана отырып, (1.91) түріндегі өрнекке ие болады.
dU =
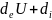 U;
(1.92)
U;
(1.92)
d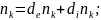 (1.93)
(1.93)
dS =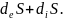 (1.94)
(1.94)
Энергияның сақталу заңына (термодинамиканың бірінші заңына) байланысты ішкі жүйенің энергиясы өздігінен тумайды және жоғалмайды:
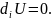 (1.95)
(1.95)
Ішкі жүйеде энергия жоғары формадан (кинетикалық, потенциалдық) төменгі формаға (жылулық) түрлене алады.
Молярлы сандар тек ішкі жүйенің химиялық реакция есебінен ғана өзгере алады:
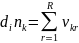 d
d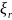 ,
(1.96)
,
(1.96)
мұндағы – r-й реакциясының айналым саны, ол реакцияның қалай жақсы өтіп жатқанын көрсетеді.
Термодинамиканың екінші заңына сәйкес
S (1.97)
ашық жүйенің ішкі энергиясы, молярлық саны және энтропиясы deZ шамасы есебінен термодинамика заңдарын бұзбай жоғарылай және төмендей алады.
Әдетте ағынды және ағынсыз процестер есебінен энтропияның өзгеруі оңды және теріс бола алады. Энтропияны ортаға немесе теріс энергияны (негэнтропия) жұтуға қабілетті жүйе өзінің энтропиясын төмендетуі мүмкін.
Сонымен ашық және оқшауланған жүйелерде энтропияның іс-әркеті принципиалды түрде ажыратылады. Бұл дегеніміз ашық жүйелерде термодинамиканың екінші заңын бұзбай, құрылымдарды құруға және іске асырауға болады.
Ашық жүйедегі тепе-теңдік ағымы түсінігі терең мағынаға ие.[4]
Ағымдағы тепе - теңдікті біз – стационарлы (уақытқа тәуелсіз) ашық жүйенің тепе-тең емес күйін аздаған ауытқуларына байланысты тұрақты деп түсінеміз.
Ағымдағы тепе –теңдік күйіндегі термодинамикалық функциялар өзгеріссіз қалады, dZ=0 төмендегі жазуға да болады:
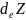 = -
= -
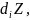 (1.98)
(1.98)
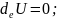
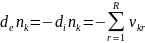 d
d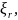 (1.99)
(1.99)
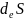 = -
= -
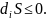
Химиялық реакция арқылы өзгерістің теңелуін,сонымен қатар заттардың келуіне (құйылуына) жүйеде энтропия өндірісін теңелтуші, жүйе көлеміне теріс энтропияның келуі ағымдағы тепе-теңдікті (тұрақты күйдің орнықтылығы) ұстау үшін қажет.
Термодинамикалық және ағымдағы тепе-теңдік аралығындағы принципиалдық айырмашылық соңғы жағдайда энтропияның шектік өндіруінің бар болуында. Ағымдағы тепе-теңдік кезінде және (1.98) формуласында тепе-тең емес белгі ғана қалады.
Термодинамикалыққа қарағанда ағымдағы тепе-теңдікте заттар мен энтропиялардың ағындары бар және нөлге тең емес , компенсациялау эффектісі арқасында термодинамикалық шаманың балансына әсер етпейді.
deU=0 теңдігі - ағымдағы тепе-теңдіктің келу және кету процестерінің әрқашан жинақты екенін көрсетеді. dS>0 жүйеге келіп жатқан, әрқашан диссипативті, яғни энергияның шашырауы мен төмендеуінің ара қатынасын білдіреді. Энергияның диссипациясы – ағымдағы тепе-теңдіктің негізгі белгісі.
Ақпарат пен энтропия арасындағы арақатынас туралы сұрақты қарастырайық. Жүйе туралы ақпараттар саны мына формуламен анықталады[8]
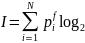 (
(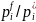 ),
),
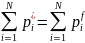 =1.
(1.100)
=1.
(1.100)
мұнда
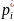 -
N нұсқасымен өткізіле алатын a
priori(тәжірибеге
дейін)ықтималдылық,
-
N нұсқасымен өткізіле алатын a
priori(тәжірибеге
дейін)ықтималдылық,
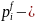 a
posteriori(тәжірибеге
кейін)өткізу ықтималдылығы.
a
posteriori(тәжірибеге
кейін)өткізу ықтималдылығы.
Таңдау немесе жүзеге асырудың апостериорлық (тәжербиеге негізделіп шыққан; бар материалдардың генізіне сүйенген) екі нұсқасы бар:
Сырттан әсер ететін күштер нәтижесінде, бұл жағдайда ақпараттың басқа жүйеден алуын айтамыз;
Аяқ астынан, яғни жүйенің тұрақсыз мінезінен болады, бұл жағдайда жаңа ақпараттың туындауына алып келеді.
(1.72) және (1.74) формаларының сәйкес келуі ақпарат пен энтропия (басқару теориясында жай-күй тұрлаусыздығының не осы жағдайдағы жүйе қылығының өлшемі) ұғымдарының бір-бірін толықтырып отыратындығын екендігін дәлелдейді. Нақтырақ айтар болсақ, энтропия – жүйенің жағдайы туралы жетпей қалған ақпараттар және (немесе) ақпарат – жетпей қалған энтропия, яғни ақапараты бар жүйедегі максималды энтропиядан айырмашылығы және нақты энтропия, бұл жүйе бар ақпаратпен иемденеді. Бұл байланысты негэнтропия ұғымы қолданылады, ол ақпарат ұғымымен сәйкес келеді.
Енді кезекте түсінігімізді кеңейте түсейік. Яғни ашық және оқшауланған жүйелер туралы қарастырайық. Мысалы, жүйе жылуда оңашалаған болса, бірақ ақпараттық қатынасқа келгенде , термодинамиканың екінші заңына қарайды, dS теңсіздігі мен dS+dI теңсіздігін орын алмастырады. Сайып келегнде, егер ақпарат ағымы бар болса, жүйенің жылу энергиясын мехникалық энергияға алмастыруға болады.(тоңазытқыштың көмегінсіз). Басқа сөзбен айтқанда, өзіне ақпарат алатын мәңгілік екінші типті қозғалтқыш болуы мүмкін дегенді білдіреді.
Тірі жүйелер келесідей артықшылықтарға ие:
Өз алдына жағдайларын өзгерте алады – олар оталған көлік аккумуляторына, сағатқа ұқсайды;
Ішкі күштерге қарсы тұруы, яғни ол қоршаған орта қалпындағы жағдайны басқа қалыпқа өзгеруі;
Тұрақты жұмыстың қоршаған ортаға бірсыдырғы қарсы болуы;
Үшінші ерекшелік термодинамикалық сипатта: егер тірі емес жүйелердегі орнықтылық бірыңғай тепе-тең жағдайда болса, ал тірі – орнықтылығы тұрақсыз. Соған қарамастан, белгілі бір шартарға байланысты босап шығатын еркін энергиялар тірі жүйе құрылымы болып табылады. Олардың өзгерістерінен теңсіздік жағдайы орын алады.
Тірі жүйелер ерекшеліктеріне олардың қоршаған ортамен ұшалақтық қатынаста болады, олар қоршаған ортамен алаңсыз ламасып отырады: массамен, энергиямен, ақпаратпен. Қоршаған ортада болып жатқан барлық болып жатқан жайдайлар, оның ішінде тірі жүйелерде бар, ретсіздікті ұлғайтады. Олар да ретсіздікті ұлғайтады, бірақ олар теріс энергия, яғни негэнтропия(ақпарат) қоршаған ортадан шығатын теңсіздікті қолдап отырады. Алмасу мағынасы – оң энтропияны босатып, терісін шығарады.
1.12. Биологиялық жүйедегі зат алмасу процессін моделдеу
Барлық деңгейде организация тірі жүйелері ашық болып табылады. Өз алдында жеке өмір сүре алатын, даму алатын элементар тірі жүйе жасуша болып табылады. Біржағынан олар автномды болу керек қоршаған ортамен қатынасы кезінде, ал екінші жағынан қоршаған орта мен қалыпты түрде энергия және зат алмасып отырады.
Жасушаның ең басты өмір сүру шарттары – биологиялық жарғақшалардың қалыпты түрде жұмыс жасауы, олар келесідей қызметтер атқарады:
Кедергілі (қоршаған ортамен белсенді, енжар және тұрақты зат алмасуды қамтамасыз етіп отырады);
Механикалы (жасушаның автономды және тұрақтылығына қамтамасыз етеді);
Қалыптамалық (жарғақша ақуыздарының ориентациясын және орналасуын қамтамасыз етеді);
Энергиялық (АТФ синтезі);
Биопотенциалдарды жеткізу және генерациялау;
Рецепторлық.
Адам ағзасындағы биологиялық жарғақшалар он мыңдаған квадрат метр көлімдң алып жатыр.
Біз қатты, сұйық және газ тәрізді моделдерді қарастырдық. Қатты дене кристал тәріздес жағдайда болуы мүмкін және аморфтық шыны тәріздес те болуы мүмкін.
Молекулалардың орналасуы және өзара қатынас ориентациясның физикалық жағдайы орын алады, бірақ агрегаттық күйі сұйық сұйықкристалды деп атаймыз.
Липидтік екі қабатты жарғақшаларына ішкі шарттар өте сезімтал әсер етеді (темперутура, қысым, химиялық құрамы). Егер қандай да бір өзгерістер болған жағдай басқа фазалы жағдайға көшіп кетеді (сұйық – қатты денеге,құрылымын өзгертеді).
Биожарғақшалар арқылы транспорттық зат алмасу үшін – өмір сүрі шарттары болу керек, яғни олармен метаболзим жасушалары, биоэнергетикалық процестер, биопотенциалдардың пайда болуы, жаңа импульстердің генерациялануы және т.б. байланыстырады.
Химиялық потенциалы µk болатын k-ны кеңдік немесе көлемі деп айтайды, оны Гиббс энергиясымен және тұрақты температурадағы бір моль теңестіреді, ал басқа заттар үшін ml(l≠k)
Μk=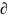 G/
mP,T,ml≠k=const
(1.101)
G/
mP,T,ml≠k=const
(1.101)
Cконцентрация ертінсі заты үшін келесідей,
μ=μ0+RTlnC (1.102)
Мұндағы µ0 - стандартты химиялық потенциал, ол 1 моль/л концентрация ертіндісі үшін.
Электрохимиялық
потенциал
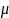 /
- көлемі, электр өрісіндегі Гиббс
энергиясы бір моль теңестірілген.
/
- көлемі, электр өрісіндегі Гиббс
энергиясы бір моль теңестірілген.
Ерітінді үшін
μ̃=μ0 +RTlnC+ZFφ (1.103)
Мұнда
Ғ= 96 500 Кл/моль – Фарадей саны; Z –
электр өріснің заряды;
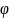 – электр өрісіндегі потенциал; Т[К] –
температура; R= 8,31 Дж/(К.моль) – универсалды
газ тұрақтысы.
– электр өрісіндегі потенциал; Т[К] –
температура; R= 8,31 Дж/(К.моль) – универсалды
газ тұрақтысы.
Жарғақша арқылы заттарлдың енжар орын ауыстыруы – бұл орынауыстыру үлкен мағыналы электр потенциалынан кіші мәнді орынға ауысқанда (1.5- суретте көрсетілген).
Гиббс энергиясының азаюынан енжар орын ауыстыру болады, сондықтан бұл процесс өзімен –өзі орындаулуы мүмкін.
1.5-сурет. Енжар транспорттық заттардың сызбасы
Заттар ағыны тығыздығы jm енжар орынауыстыру кезінде Теорелла теңдігіне тең:
Jm=-UC dμ̃/dx (1.104)
Мұндағы
U – бөліктердің қозғалуы; С – консентрациясы;
азайту таңбасы орын ауыстырудың азаюы
жағына кетуін көрсетеді
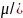 .
.
Заттар ағына тығыздығы – перпендикуляр бағыттағы орын ауыстыру кезіндегі және орын аусытырудағы бір уақыт, аумақ көлемі бір болатын саны заттар санына тең :
Jm=m/St(моль/м2с)
(1.104) формуласына (1.102) формуласындағы электрохимиялық потенциалын қойып, араластырылған µ0 =const болатын Нернста-Планканың теңдігін аламыз:
Jm=-URT dC/dx-UCZF dφ/dx (1.105)
Сонымен, Зат орын алмастыру кезінде транспорттық енжар болуына екі себеп болуы мүмкін: градиент концентрациясы және градиент потенциалы. Теріс таңба градиент концентрациясының үлкен концентрациядан кіші мәнді концентрация орын алмастыруын көрсетеді. Электр потенциалының градиенті оң зарядты орын ауыстыруды көрсетеді, онда үлкен потенциалдан кіші потенциалға қарай орын ауыстырады.
осы екі себептерді жеке-жеке алғанда енжар орын ауыстыру үлкен концентрациядан күші концентрацияға орын алмастырады.
Ал элеткрлік емес болса , яғни (Z=0) электр өрісінің болмауы Теорелла теңдеуінен келесідей формулаға өтеді:
Jm=-URT dC/dz
Эйнщтейн диффузиялық коэффициенті бойынша D = URT. Нәтижесінде, қарапайым диффузияны сипаттайтын Фик заңдылығына келеді:
Jm=-D dC/dx (1.106)
1.6 суретте жарғақша арқылы заттардың енжар орын алмастыру негізгі жіктеулері көрсетілген, ал 1.7 суретте жарғақша арқылы өтетін қарапайым диффузияның негізгі түрлері көрсетілген.
Диффузия – өз еркімен концентрациясы үлкен жерден контрациясы кіші жерге орын ауыстыруынан болатын хаотикалық жылу қозғалысындағы молекулалар.
Липидтік екі қабаттан өтетін диффузия заттар (1.7 а суретте), жарғақшадағы градиент концентрациясын туындатады.
Фик заңы бойынша заттар ағының тығыздығы
Jm=-DgradC≈-D C2M-C1M/l=D C1M -C2M/l (1.107)
Мұндағы С1 - жоғарғы беттегі бір жарғақшадағы айналасындағы концентрация; С2 – басқа жоғарғы бет; l – жарғақша қалындығы.
1.6. Сурет. Заттардың енжар орын алмастыруын жіктеу түрлері
1.7. сурет. Жарғақша арқылы қарапайым диффузиясының негізі түрлері; липидтік екіқабат арқылы (а): липидтік екіқабат тесіктері арқылы (б): ақуыз тесңтері арқылы; (в)[7]
Градент концентрациясы шамамен тең:
С1, С2 концентрациясын өлшеу қиын сондықтан практикада келесідей формула қолданылады,яғни заттар ағыны тығыздығын жарғақша арқылы сол заттың концентрациясының сыртындағы ерітіндегі жарғақша жоғарғы бетінде С1, және С2 (1.8 суретте көрсетілген):
Jm=P(C1-C2) (1.108)
Мұндағы, Р – жарғақша өткізгіштігінің коэффициенті.
Сонымен,
заттар ағыны тығыздығ j моль/(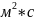 ),
С концентрация (моль/
),
С концентрация (моль/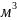 ),
өткізгіштік коэффициенті Р (м/c).
),
өткізгіштік коэффициенті Р (м/c).
1.8.сурет. қарапайым диффузияның липидті екіқабат арқылы жарғақшасының сызбасы
Өткізгіштік коэффициенті жарғақшаның ерекшелігіне және заттар орын алмастыруна тәуелді.
Егер жарғақшадағы заттар концентрациясы жарғақша сыртындағы жоғарғы концентрациясына тура пропорционалды болып келсе, онда
C1M=KC11.109а
C2M=KC21.109б
К дегеніміз бөлу коэффициенті болып табылады, ол заттардың жарғақша сыртындағы және жарғақша ішіндегі қонцентрациясы қтынасын көрсетеді. 1.109а және 1.109б формулаларын қорыта келе келесідей формула аламыз,
Jm=KC/l(C1-C2) (1.110)
(1.108),(1.110) теңдеулері арқылы өткізгіштік коэффициентін аламыз.
P=KC/l (1.111)
Өткізгіштік коэффициенті неғұрлым үлкен болса, солғұрлым диффузия коэффициенті де үлкен болады, солғұрлым жарғақша жұқа болады және солғұрлым жарғақшадағы зат жақсы ериді.
Липидті және ақуыз тесіктері арқылы (1.7 б,в суретте) жарғақша арқылы молекулалар араласпйтын липидтер заттары және суда еритін гидратталған иондар арқылы өтеді. Майда еритін заттар үшін және жарғақша иондары молекулярлық сит болып табылады: жарғақша өлшемі неғұрлым үлкен болса, солғұрлым осы зат үшін жарғақшаны тесіп өту төмен болады.
Орын алмастыруды жіктеуді қамтамасыз ету жарғақшадағы тесіктер радиусына қарай, өтетін бөліктер өлшеміне сай келеді. Бұл бөлінулер жарғақша потенциалына байланысты.
Биологоиялық жарғақшада диффузияның тағы бір түрі анықталды – жеңілдетілген диффузия. Олар молекула тасушылардың қатысуымен жүзеге асады. Мысалы, валиномицин – калий ион тасымалдаушы. Валиномицин молекуласы теңгежапырақ тәріздес болады, іші полярлы, ал сырты полярлы емес болып келеді.
Валиномицинның химиялық құрылымдыдағы өзгерістер, біріншіден, калий иондарымен біріге алады, екіншіден, ол жарғақшаның липидті фазасында ери алады. Валиномицина молекуласы жарғақша жоғарысында болған жағдайда ерітінді арасынан калия иондарын тартып алуы мүмкін.(1.9 суретте). Молекуладағы диффундируя, молекула калийді жарғақша арқылы алады. Олардың кейбіреулері ертіндідегі иондарын жарғақшаның басқа бағытына қарай береді. Осылай валиномицинмен калий иондарының жарғақша арқылы орын алмастыру жүзеге асады.
1.9.сурет. Валиномицинмен калий иондарының жарғақша арқылы орын алмастыруы
Калий валиномицинмен жарғақша арқылы орын алмастыруы бір жақтан екінші жаққа алмастыра алу мүмкін. Егер жарғақшадағы калий концентрациясы бірдей болса, онда калий ағыны келесі жақтағы бетте де дәл солай болады. Нәтижесінде, калийдің жарғақша арқылы орын алмастыру орындалмай қалады. Ал егер калий бір жақ бетінде көбірек болса, онда иондар алып кету молекулаға көбірек жабысады. Және калий ағыны азырақ жағында көбірек болады келесі жағына қарағанда.
Жеңілдетілген диффузия,сайып келгенде, концентрауиясы көп жерден концентрациясы аз жерге қарай орын алмастырады. Көріп тұрғандай, жеңілдетілген диффузия биологиялық жарғақша арқылы аминқышқылдарын, қанттарды және басқа да биологиялық маңызы бар заттарды орын алмастырады. (1.10 сурет)
1.10.сурет. Ағының тұрақты тәуелділігі Jm заттар арқылы биологиялық жарғақшадағы жасушаның ерітіндісі Снаросы заттардың жасушадан тыс қарапайым (l) және жеңілдетілген (2) диффузия (жасуша ішіндегі ерітінді айтарлықтай өзгереді деп есептеледі) [7]
Сүзгілеу деп жарғақшадағы (мембранадағы) ұсақ тесіктер арқылы сұйықтық қозғалысына градиеттік қысым арқылы әсер етуін айтамыз.
Сүзгілеу кезіндегі жылдамдықтың тасымалы Пуазейля заңына бағынады
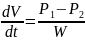
dV/dt – үлкен көлемді cұйықтық тасымалдау кезіндегі жылдамдық ; W – гидравликалық кедергі; l – ұсақ тесіктер ұзындығы; r – оның радиусы; Ƞ - сұйықтықтың қоюлану коэффициенті.
Сүзгілеу құбылысы қан тамырлары жақтары арқылы өтетін су тасымалдау процессінде өте маңызды рөл атқарады.
Осмос – жартылай өткізгіштік жарғақшалардағы кіші көлемді концентратция ертіндісі орнына үлкен көлемді концентрациялы ертіндісін молекула қозғалысы артықшылықтары болып табылады. Осмос – кіші концентрация ертіндісі орнына улкен концентрациясынан тұратын қарапайым су диффузиясы. Осмос көптеген биологиялық құбылыстарда өте маңызды рөл атқарады. Осмос құбылысы гипотоникалық сұйықтардағы гемолиз эритроциттерін қамтамасыз етеді.
Белсенділер – зат тасымалдау немесе алмасу электрохимиялық потенциалдың белгілі бір кіші мағыналы орнынан улкен мағынаға өзгеруі кезінде орын алады. (Ол 1.11-суретте көрсетілген).
Жарғақшадағы белсенді транспорты Гиббс энергиясының жоғарылауымен басқарылады. Ол өз алдына өз еркімен жүре алмайды, тек қана аденозинтрифосфорлы қышқылды гидролиз процессінің басқараумен, сайып келгенде, макроэргикамен байланыстағы аденозинтрифосфорлы қышқылды гидролиздағы энергия шығындау арқылы орынлады.
Белсенді тасымалдаудың бағыты
1.11-сурет. Белсенді зат тасымалдау сызбасы
Белсенді транспортық заттар биологоиялық жарғақшаларда улкен мағынаға ие, яғни улкен рөл атқарады. Соның әсерінен ағзадағы концентрация градиенті, электрлі потенциалдар градиенті, қысым градиенті және тағы басқа да өмір сүру құбылысын бірыңғай ретке келтіріп отырыатын, яғни термодинамикалық тұрғыдан қарағанда, белсенді тасымалдау ағзадағы әртүрлі жағдайларды реттеп отырады, өмір сүруді қалыпқа келтіріп отырады.
Электрогендік иондар сорғышы. Қазіргі заманғы анықтамаларға сәйкес биологиялық жарғаұшаларда иондар соғышы бар, олар арнай жүйедегі интегралды ақуыздар бос гидролиз энергиясы есебінен жұмыс жасайды.
Жарғақшалар арқылы белсенді тасымалдаулардың жүзеге асырылатын электрогенді иондық сорғыштардың атақты үш түрі бар.
АТФ фазалы транспорттық иондардың тасымалдануы метаболизм жасушаларының энергиясы есебінен болатын химиялық реакциялармен тасымалданатын процесстер кедергілерінің әсерінен болады.
Екінші белсінді иондардың тасымалдау. Иондарды сорғыштардан басқа заттай жинақтаудың АТФ гидролизіндегі емес, қалыпына келтіретін қышқылдандыратын ферментермен немесе фотосинтезбен жұмыс жасайтын ұсқас жуйелер бар, Заттай транспорт бұл жағдайда екінші орында, жанама орында яғни, жарғақша потенциалы және\немесе жарғақшада арнайы тасымалдаулар болған жағдайдағы иондардың градиентті концентрациясы болып табылады. Сонындай құрылым екінші белсенді транспорт деп аталады.
Осындай тасымалдау жүйелері артықшылық етеді, өйткені биологиялық транспорттың ерекцше қасиеттерін ионды сорғыштар қамтамасыз етеді: электр өрісіне және диффузияға қарсы тасымалдауларды аса жоғары таңдаумен орындайды. Бұндағы қарама қайшылық, бирақ та басқаратын осындай ағындардың санының шексіз көп болуына қарамасатан, сорғыштардың үш қана түрі болғандығында.
Осы жағдайда екінші белсенді транспорт деп аталатын иондар кедергісі құрылымы ерекше мәнге ие болады. Оларда диффузиялық процесс ең басты рөлді атқарады.
Сайып келгенде, белсенді транспорттық заттар мен жарғақшалық жасушадағы диффузиялық тасымалдау ұғымдарының бірігуі жасушаның және бүкіл ағзаны толығымен алғандағы өмір сүруін қамтамасыз етеіп отырады.
Бақылау сұрақтары
1.Анықталған траектория ортасынан қозғалыс заңын табу мүмкін бе?
2.Дәл қазіргі уақытта ток сызықтарынан жылдамдықтың лездік мәнін анықтауға болама?
3.0°-15° дейін қайнаған судан энтропиянын өзгерісін анықтау керек.
4.Термодинамикалық жүйенің стационарлық жағдайы мен тепе-теңдік жағдайының негізгі айырмашылығы неде?
5.Стационарлы жағдайда тірі организмнің энтропиясының ортақ баланысы неге тең?
6.Егерде барлық бөлшек біркелкі болса;уақыт бойынша әр нүктеде жылдамдық орны өзгермесе ортақ бөлшек үдемелі қозғалама?
7.Әрқашан өзіндік бөлшек нығыздығы түйінделмейтін ортада қалады.Уақыт байланысты әр нүкте орнында нығыздығы өзгеруі мүмкін бе?
Екінші бөлім. Екі аяқпен жүруге арналған қарқынды-қозғалмалы жүйесінің құрылымы.
Адамның қарқынды қозғалмалы жүйесі механика көз қарасымен қарағанда, бұл құрылым ағзаның өмір сүру функцияларын жүзег асыруға арналған құрылым. Оның ерекшелітеріне екі аяқ және тік тұру жағдай жатады. Дәл солар адами арнайы мәселелерді туғызады.
Екі аяқпен жүру төрт аяқтпен жүруден алде қайда айырмашылығы бар және ол айқын: дененің тік тұру қалпы қаңқаға үлкен әсерін тигізеді, ең бірінші арқа омыртқа және буындарға әсер етеді.Ескере кететін жағдай, қозғалыс жүйесі Жер тартылыс өрісінде болады.
Леонардо да Винчидің зерттеулері бойынша адамдардың қозғаласы механика заңдылықтарына бағынады деп көрсеткен.
Адмдардың, жануарлардың қозғалысын зерттеулерден көріп отырғандай даму эволюциясы процессінде техникалық жүйеге қарағанда анағұрлым пайдалы қозғалыс түрлері пайда болып отыр. Осыған қарап, соңғы он жылдықтарда биологиялық жүйедегі математикалық ммоделдеу динамикасына қызығушылық тұрақты түрде өсіп отыр. Моделдеуді қалыптастырушы жалпы механикалық құрылым заңдылыықтары болып табылады, бирақ та биологиялық аспект маңызды әсер етіп отырады.
