
- •Оглавление
- •Часть I. Механика 4
- •Часть II. Молекулярная физика и термодинамика 81
- •Часть I. Механика
- •Кинематика
- •Основные понятия кинематики
- •З.2. Скорость
- •Среднее ускорение
- •Мгновенное ускорение
- •Ускорение точки при прямолинейном движении
- •Кинематика вращательного движения
- •4. Динамика
- •Закон всемирного тяготения
- •2). Сила тяжести
- •3). Сила реакции опоры
- •4). Сила трения
- •Виды трения
- •5). Сила упругости
- •4.4. Импульс. Закон сохранения импульса
- •История появления термина
- •4.5. Законы Ньютона
- •Замечания:
- •4.6. Энергия
- •Потенциальная энергия тела, поднятого над поверхностью Земли
- •Закон сохранения энергии в механике
- •4.7. Динамика вращательного движения
- •2). Пара сил
- •Момент импульса
- •Механический (классический) принцип относительности (принцип относительности Галилея)
- •Основы механики жидкостей и газов
- •Архимед из СиракузArchimedes of Siracuse, ок. 287–212 г. До н. Э.
- •Условие плавания тел
- •Вязкость газов
- •Часть II. Молекулярная физика и термодинамика
- •I. Молекулярная физика
- •1.1. Предмет молекулярной физики
- •1.2. Внесистемные единицы измерения величин в микрофизике физике
- •1.3. Основные положения молекулярно-кинетической теории строения вещества
- •1.4. Число степеней свободы молекул
- •1.5. Термодинамическая система. Термодинамические состояние и процесс
- •1.6. Статистический метод в молекулярной физике
- •1.7. Количество вещества. Масса молекул
- •1.8. Идеальный газ
- •1.9. Закон равномерного распределения энергии по степеням свободы молекул
- •1.10. Закон Максвелла25 о распределении молекул идеального газа по скоростям
- •Вывод распределения по Максвеллу
- •Границы применимости
- •Зависимость функции распределения Максвелла от температуры.
- •Характерные скорости Наиболее вероятная скорость
- •Средняя скорость
- •1.11. Основное уравнение молекулярно – кинетической теории (уравнение Клаузиуса26)
- •1.12. Уравнение Менделеева27 - Клапейрона28
- •1.13. Барометрическая формула. Распределение Больцмана
- •1.14. Средняя длина свободного пробега молекул
- •II. Термодинамика
- •2 .1. Термодинамический метод
- •2.2. Внутренняя энергия
- •Два способа изменения внутренней энергии. Теплота и работа
- •Первое начало термодинамики
- •Нулевое начало термодинамики
- •Теплоёмкость
- •1). Молярная теплоёмкость идеального газа при постоянном объёме
- •2). Молярная теплоёмкость идеального газа при постоянном давлении Уравнение Майера
- •Термический кпд для кругового процесса
- •Из истории тепловых двигателей
- •Цикл Карно38
- •Второе начало термодинамики
- •Энтропия
- •2.16. Статистическая интерпретация второго начала термодинамики
- •Реальные газы
- •Жидкости
- •Твёрдые тела
- •Изоморфизм и полиморфизм кристаллов
- •Кристаллические вещества Типы кристаллических решеток
- •Общая характеристика
- •Классификация решёток по симметрии
- •Объём ячейки
Реальные газы
Реальный газ – газ, свойства которого (в отличие от идеального газа) зависит от взаимодействия молекул.
Свойства этих газов резко отличаются при высоких давлениях и низких температурах, когда начинают проявляться квантовые эффекты.
Силы и потенциальная энергия межмолекулярного взаимодействия
Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяет описывать поведение разреженных реальных газов при достаточно высоких температурах и низких давлениях. При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объем молекул и взаимодействие между ними. Taк, в 1 м3 газа при нормальных условиях содержится 2,68×1025 молекул, занимающих объем примерно 10–4 м3 (радиус молекулы примерно 10–10 м), которым по сравнению с объемом газа (1 м3) можно пренебречь. При давлении 500 МПа (1 атм = 101,3 кПа) объем молекул составит уже половину всего объема газа. Таким образом, при высоких давлениях и низких температурах указанная модель идеального газа непригодна.
При рассмотрении реальных газов — газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они проявляются на расстояниях r 10–9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
Межмолекулярные взаимодействия - взаимодействия молекул между собой, не приводящее к разрыву или образованию новых химических связей. Межмолекулярные взаимодействия определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От межмолекулярных взаимодействий зависят многие структурные, спектральные, термодинамические, теплофизические и другие свойства веществ.
Основу межмолекулярных взаимодействий составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой.
По мере развития представлений о строении атома и квантовой механики, было выяснено, что между молекулами вещества одновременно действуют силы притяжения и силы отталкивания. На рис. 134 a приведена качественная зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где Fо и Fп — соответственно силы отталкивания и притяжения, a F — их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения — отрицательными.


Рис. 134.
На расстоянии r = r0 результирующая сила F = 0, т.е. силы притяжения и отталкивания уравновешивают друг друга. Таким образом, расстояние r0 соответствует равновесному расстоянию между молекулами, на котором бы они находились в отсутствие теплового движения. При r < r0 преобладают силы отталкивания (F>0), при r > r0 — силы притяжения (F<0). На расстояниях r > 10–9 м межмолекулярные силы взаимодействия практически отсутствуют (F = 0).
Элементарная работа A силы F при увеличении расстояния между молекулами на dr совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е.
A = F dr = - dП, (1)
где П – потенциальная энергия межмолекулярного взаимодействия.
Из анализа качественной зависимости потенциальной энергии взаимодействия молекул от расстояния между ними (рис. 134, б) следует, что если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют (r ), то П=0. При постепенном сближении молекул между, ними появляются силы притяжения (F<0), которые совершают положительную работу ( = Fdr>0). Тогда, согласно (1), потенциальная энергия взаимодействия уменьшается, достигая минимума при r = r0. При r < r0 с уменьшением r силы отталкивания (F>0) резко возрастают и совершаемая против них работа отрицательна ( A=Fdr <0). Потенциальная энергия начинает тоже резко возрастать и становится положительной. Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия (r = r0) обладает минимальной потенциальной энергией.
Критерием различных агрегатных состояний вещества является соотношение между величинами Пmin и kT. Пmin — наименьшая потенциальная энергия взаимодействия молекул — определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (r = r0); kT определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического (теплового) движения молекул. Возможны следующие случаи:
- Пmin<<kT – вещество находиться в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул;
- Пmin<<kT – вещество находится в твёрдом состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого расстоянием r0;
-
Пmin
 - вещество находится в жидком состоянии,
так
как в результате теплового движения
молекулы перемещаются в пространстве,
обмениваясь местами, но не расходясь
на расстояние, превышающее r0.
- вещество находится в жидком состоянии,
так
как в результате теплового движения
молекулы перемещаются в пространстве,
обмениваясь местами, но не расходясь
на расстояние, превышающее r0.
Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твердом агрегатном состоянии, причем температура перехода из одного агрегатного состояния в другое зависит от значения Пmin, для данного вещества. Например, у инертных газов Пmin мало, а у металлов велико, поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твердом состояниях.
Уравнение Ван – дер - Ваальса47
Для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клапейрона – Менделеева (для моля газа) P = RT, описывающее идеальный газ, для реальных газов непригодно.
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, голландский физик И. Ван-дер-Ваальс (1837—1923) вывел уравнение состояния реального газа. Ван-дер-Ваальсом в уравнение Клапейрона — Менделеева введены две поправки.
1). Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не , а — b, где b — объем, занимаемый самими молекулами, - молярный объём.
Объем b равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса d, т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
2).
Учет притяжения молекул. Действие
сил притяжения газа приводит к появлению
дополнительного давления на газ,
называемого внутренним давлением.
По вычислениям Ван-дер-Ваальса. Так
как сила, действующая на каждую молекулу
со стороны остальных, пропорциональна
числу окружающих молекул, т.е. плотности
газа, то и
 будет пропорциональна квадрату
плотности газа или обратно пропорциональна
квадрату объёма:. P′
=
будет пропорциональна квадрату
плотности газа или обратно пропорциональна
квадрату объёма:. P′
=
 , где а — постоянная Ван-дер-Ваальса,
характеризующая силы межмолекулярного
притяжения,
— молярный объем.
, где а — постоянная Ван-дер-Ваальса,
характеризующая силы межмолекулярного
притяжения,
— молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов): (P + ) ( – b) = RT.
Для
произвольного количества вещества v
газа (v
=
)
с учетом того, что V=v
уравнение Ван-дер-Ваальса примет
вид: (P
+
 )
(
)
( b)
= RT)
или
b)
= RT)
или
(P
+
)
(V
 b)
=
RT,
b)
=
RT,
где поправки а и b — постоянные для каждого газа величины, определяемые опытным путем.
В
СИ: [a]
=
 ;
[b]
=
;
[b]
=
 .
.
Для нахождения критических параметров подставим их значения в уравнение Ван – дер - Ваальса и запишем: РкV3 (RTк + Ркb)V2 + aV ab = 0. (1)
Поскольку в критической точке все три корня совпадают и равны Vк уравнение приводится к виду: Рк(V Vк)3 = 0, (2)
или
РкV3
3РкVкV2
+ 3Рк V
РкVк
= 0.
V
РкVк
= 0.
Taк как уравнения (1) и (2) тождественны, то в них должны быть равны и коэффициенты при неизвестных соответствующих степеней. Поэтому можно записать:
Рк = ab;
3Рк
= a;
3Рк
= ab;
3Рк
= a;
3Рк = RTк
+ Ркb.
(3)
= RTк
+ Ркb.
(3)
Решая
полученные уравнения, найдем:
= 3b;
Рк
=
 ;
Tк
=
;
Tк
=
 .
.
Уравнение Ван – дер – Вальса – уравнение третьей степени относительно V, следовательно, имеет три корня (два из которых могут быть комплексными), т.е. при постоянной температуре и определённом давлении у моля газа могут быть три различных объёма.
Реальные газы описываются уравнением Ван – дер – Ваальса лишь приближённо. В целом уравнение Ван – дер – Ваальса даёт лишь качественную картину реального газа. Существуют и другие уравнения, некоторые из них даже точнее описывают реальные газы, но не рассматриваются из-за их сложности.
Внутренняя энергия реального газа
Внутренняя энергия реального газа будем определяться суммой кинетической энергии K теплового движения его молекул и потенциальной энергии взаимодействия молекул между собой - П: U = К+П.
Кинетическая
энергия поступательного и вращательного
движений молекул определяет внутреннюю
энергию идеального газа:
 =
RT=
CVT,
где
CV
– молярная
теплоёмкость газа при постоянном объёме.
=
RT=
CVT,
где
CV
– молярная
теплоёмкость газа при постоянном объёме.
Работа сил молекулярного сцепления, которые вызывают внутреннее давление и изменение объёма dV: = dV.
Так
как
=
 ,
то
изменение потенциальной энергии, которое
произошло за счёт совершения работы
,
равно:
d
,
то
изменение потенциальной энергии, которое
произошло за счёт совершения работы
,
равно:
d =
dV.
=
dV.
Интегрируя
это выражение, получим:
=
 + const.
+ const.
Const
находится из условия, что расстояние
между молекулами при безграничном
увеличении объёма возрастают и
потенциальную энергию при этом следует
считать равной нулю: V
,
то
 0 и const=
0.
0 и const=
0.
Для конечного объёма V потенциальная энергия моля газа равна: = .
Внутренняя энергия моля реального газа равна: = + = CVT .
Таким образом, внутренняя энергия реального газа зависит от температуры T и объёма V: = CVT . (1)
Последнее уравнение справедливо для моля реального газа.
Из формулы для внутренней энергии реального газа следует, что его внутренняя энергия растет как с увеличением температуры, так и с увеличением объема. Если реальный газ будет расширяться или сжиматься адиабатически и без совершения внешней работы, то для него, согласно первому началу термодинамики:
ΔQ = ΔU + ΔA; ΔQ = 0, ΔA = 0; ⇒ ΔU = 0 → U = const,
и
внутренняя энергия должна оставаться
постоянной. Поэтому, из формулы (1) для
реального газа, совершающего адиабатический
переход без совершения работы, можно
записать: T1
-
T2
=
(
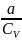 )
[(
)
[( )
-
(
)
-
( )]
.
)]
.
Из этого уравнения следует, что изменение объема и изменение температуры имеют разные знаки. Следовательно, при адиабатическом расширении в вакуум, реальный газ должен охлаждаться, а при сжатии - нагреваться.
Отметим, что для идеального газа этот эффект не наблюдается:
ΔU = CvΔT = 0 → ΔT = 0 → T = const.
Рассмотрим расширение реального газа в пустоту. В этом случае внешнее давление равно нулю, поэтому газ не совершает работу против внешних сил. Но в реальном газе действуют силы межмолекулярного взаимодействия, и при расширении газа совершается работа по преодолению этих сил за счет внутренней энергии газа. Вследствие этого температура реального газа при расширении в пустоту должна понижаться.
Однако это не совсем так. в некоторых случаях может происходить и повышение температуры. Реальный газ при расширении охлаждается в том случае, когда преобладает действие сил притяжения между молекулами газа. Тогда молекулы газа совершают работу против сил притяжения за счет своей кинетической энергии, вследствие чего кинетическая энергия уменьшается, т.е. температура понижается. Если преобладает действие сил отталкивания между молекулами газа, то при расширении скорость молекул не уменьшается, а увеличивается, т.е. температура возрастает.
Следовательно, в зависимости от того, что преобладает — силы притяжения между молекулами или силы отталкивания, — может получиться при расширении газа в пустоту или нагревание газа, или охлаждение.
Изменение внутренней энергии реального газа при расширении положено в основу принципа действия машины для сжижения газов.
Изотермы Ван – дер - Ваальса
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса — кривые зависимости Р от при заданных Т, определяемые уравнением Ван-дер-Ваальса для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 135) имеют довольно своеобразный характер. При высоких температурах (T > Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Tк на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой; точка перегиба К называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк, и давление Рк называются также критическими. Состояние с критическими параметрами (Рк, Vк, Tк) называется критическим состоянием. При низких температурах (Т < Tк ) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
 Рис. 135.
Рис. 135.
При T Tк стирается различие между жидким и газообразным состоянием вещества, различие в плотности жидкости и пара, обращаются в нуль удельная теплота парообразования и коэффициент поверхностного натяжения (рис. 136).

Рис. 136.
Для
пояснения характера изотерм преобразуем
уравнение Ван-дер-Ваальса к виду: P (RT
+ Pb)
(RT
+ Pb)
 + a
ab
= 0.
+ a
ab
= 0.
Уравнение Ван – дер - Ваальса при заданных P и Т является уравнением третьей степени относительно ; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема газа V1, V2 и V3 отвечают (символ « » для простоты опускаем) одному значению давления P1, второму случаю — изотермы при высоких температурах.
Рассматривая различные участки изотермы при T<Тк (рис. 137), видим, что на участках 1—3 и 5—7 при уменьшении объема давление Р возрастает, что естественно. На участке 3—5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7—6—2—1. Часть 6–7 отвечает газообразному состоянию, а часть 2–1 — жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6—2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.

Рис. 137.
Данные выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами ирландского ученого Т. Эндрюса (1813—1885), изучавшего изотермическое сжатие углекислого газа. Отличие экспериментальных (Эндрюс) и теоретических (Ван-дер-Ваальс) изотерм заключается в том, что превращению газа в жидкость в первом случае соответствуют горизонтальные участки, а во втором — волнообразные.
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая (рис. 138), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму Р, под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. 138), видим, что последняя имеет прямолинейный участок 2—6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5—6 и 2—3. Эти неустойчивые состояния называются метастабильными48. Участок 2—3 изображает перегретую жидкость, 5—6 — пересыщенный пар. Обе фазы ограниченно устойчивы.

Рис. 138.
При достаточно низких температурах изотерма пересекает ось , переходя в область отрицательных давлений (нижняя кривая на рис. 139). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8—9 на нижней изотерме соответствует перегретой жидкости, участок 9—10 — растянутой жидкости.
Для нахождения критических параметров подставим их значения в уравнение Ван – дер - Ваальса и запишем: РкV3 (RTк + Ркb)V2 + aV ab = 0. (1)
Поскольку в критической точке все три корня совпадают и равны Vк уравнение приводится к виду: Рк(V Vк)3 = 0, или РкV3 3РкVкV2 + 3Рк V РкVк = 0. (2)
Taк как уравнения (1) и (2) тождественны, то в них должны быть равны и коэффициенты при неизвестных соответствующих степеней. Поэтому можно записать:
Рк = ab; 3Рк = a; 3Рк = RTк + Ркb. (3)
Решая полученные уравнения, найдем: = 3b; Рк = ; Tк = .

Рис. 139.
Эффект Джоуля - Томсона
Наличие потенциальной энергии взаимодействия молекул проявляется в эффекте Джоуля – Томсона: изменение температуры реального газа при изменении его объёма без теплообмена и без совершения внешней работы.
Если температура Т газа понижается (∆Т<0), то эффект считается положительным; если газ нагревается ((∆Т> 0), то эффект считается отрицательным. Если при расширении не нагревается и не охлаждается, то эффект Джоуля – Томсона равен нулю. Такое состояние отображается точкой инверсии. Точка инверсии определяет температуру, вблизи которой эффект меняет свой знак.
Положительный эффект Джоуля – Томсона используется при получении низких температур.
Глубокого охлаждения газов достигают двумя путями:
1). температура газа понижается при его расширении вследствие совершения работы против сил сцепления молекул;
2). температура газа понижается при адиабатном расширении вследствие совершения работы против внешних сил.
Применение первого способа возможно при охлаждении газа ниже температуры инверсии и ниже критической температуры. В настоящее время подвергнуты сжижению и отвердеванию все газы, включая гелий, критическая температура которого ТК = 5 К.
