
- •Оглавление
- •Часть I. Механика 4
- •Часть II. Молекулярная физика и термодинамика 81
- •Часть I. Механика
- •Кинематика
- •Основные понятия кинематики
- •З.2. Скорость
- •Среднее ускорение
- •Мгновенное ускорение
- •Ускорение точки при прямолинейном движении
- •Кинематика вращательного движения
- •4. Динамика
- •Закон всемирного тяготения
- •2). Сила тяжести
- •3). Сила реакции опоры
- •4). Сила трения
- •Виды трения
- •5). Сила упругости
- •4.4. Импульс. Закон сохранения импульса
- •История появления термина
- •4.5. Законы Ньютона
- •Замечания:
- •4.6. Энергия
- •Потенциальная энергия тела, поднятого над поверхностью Земли
- •Закон сохранения энергии в механике
- •4.7. Динамика вращательного движения
- •2). Пара сил
- •Момент импульса
- •Механический (классический) принцип относительности (принцип относительности Галилея)
- •Основы механики жидкостей и газов
- •Архимед из СиракузArchimedes of Siracuse, ок. 287–212 г. До н. Э.
- •Условие плавания тел
- •Вязкость газов
- •Часть II. Молекулярная физика и термодинамика
- •I. Молекулярная физика
- •1.1. Предмет молекулярной физики
- •1.2. Внесистемные единицы измерения величин в микрофизике физике
- •1.3. Основные положения молекулярно-кинетической теории строения вещества
- •1.4. Число степеней свободы молекул
- •1.5. Термодинамическая система. Термодинамические состояние и процесс
- •1.6. Статистический метод в молекулярной физике
- •1.7. Количество вещества. Масса молекул
- •1.8. Идеальный газ
- •1.9. Закон равномерного распределения энергии по степеням свободы молекул
- •1.10. Закон Максвелла25 о распределении молекул идеального газа по скоростям
- •Вывод распределения по Максвеллу
- •Границы применимости
- •Зависимость функции распределения Максвелла от температуры.
- •Характерные скорости Наиболее вероятная скорость
- •Средняя скорость
- •1.11. Основное уравнение молекулярно – кинетической теории (уравнение Клаузиуса26)
- •1.12. Уравнение Менделеева27 - Клапейрона28
- •1.13. Барометрическая формула. Распределение Больцмана
- •1.14. Средняя длина свободного пробега молекул
- •II. Термодинамика
- •2 .1. Термодинамический метод
- •2.2. Внутренняя энергия
- •Два способа изменения внутренней энергии. Теплота и работа
- •Первое начало термодинамики
- •Нулевое начало термодинамики
- •Теплоёмкость
- •1). Молярная теплоёмкость идеального газа при постоянном объёме
- •2). Молярная теплоёмкость идеального газа при постоянном давлении Уравнение Майера
- •Термический кпд для кругового процесса
- •Из истории тепловых двигателей
- •Цикл Карно38
- •Второе начало термодинамики
- •Энтропия
- •2.16. Статистическая интерпретация второго начала термодинамики
- •Реальные газы
- •Жидкости
- •Твёрдые тела
- •Изоморфизм и полиморфизм кристаллов
- •Кристаллические вещества Типы кристаллических решеток
- •Общая характеристика
- •Классификация решёток по симметрии
- •Объём ячейки
Первое начало термодинамики
Существуют две формы передачи энергии от одних тел к другим – работа и теплота. Энергия механического движения может превращаться в энергию теплового движения и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем. Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера34, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца35.
Нулевое начало термодинамики
Нулевое начало термодинамики названо так потому, что оно было сформулировано уже после того, как первое и второе начало вошли в число устоявшихся научных понятий. Оно утверждает, что изолированная термодинамическая система с течением времени самопроизвольно переходит в состояние термодинамического равновесия и остаётся в нём сколь угодно долго, если внешние условия сохраняются неизменными. Оно также называется общим началом. Термодинамическое равновесие предполагает наличие в системе механического, теплового и химического равновесия, а также равновесия фаз. Классическая термодинамика постулирует лишь существование состояния термодинамического равновесия, но ничего не говорит о времени его достижения.
Первый закон термодинамики
Теплота, сообщаемая системе, расходуется на увеличение её внутренней энергии и на совершение работы ею против внешних сил (рис. 121).
Первый закон термодинамики для элементарного процесса:
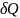 =
dU
+
=
dU
+

или
для конечного процесса: Q=
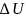 +
A.
+
A.

Рис. 121.
Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Если система периодически возвращается в первоначальное состояние, то = 0. Тогда согласно первому закону термодинамики: А = , т.е. вечный двигатель первого рода36 невозможен (рис. 122).



Рис. 122. Предлагаемые «изобретателями» в истории техники «вечные двигатели»
Энтальпия системы
Работа изменения объёма газа в изобарном процессе (m – const;P = const): A = P•dV = d (PV). (1)
С учётом формулы (1) первый закон термодинамики примет вид:
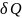 =
dU
+
=
dU
+
 = dU
+ d
(PV)
= d
(U
+ PV).
(2)
= dU
+ d
(PV)
= d
(U
+ PV).
(2)
Введём новую величину, называемую энтальпией:
I = U + PV, (Дж) (3)
Энтальпия I является функцией состояния, т.к. величины U,P.V сами являются функциями состояния.
С учётом формулы (3) при P = const первый закон термодинамики примет вид:
= ∆I = I2 – I1.
Энтальпия – функция состояния, приращение которой в изобарном процессе даёт тепло, полученное системой.
Полная энергия. Закон сохранения полной энергии
Полной энергией системы называется сумма её механической и внутренней энергий:W = Eм + U.
Замкнутой (изолированной) называется термодинамическая система, которая не обменивается энергией ни в какой форме с внешней средой.
Для такой системы справедливо: Eм = 0; = 0; А =0, тогда из первого закона термодинамики следует: dU = 0 => U= const.
Если в замкнутой системе Eм = const и U = const, то W = const.
Полная энергия изолированной системы остаётся неизменной при любых процессах, в ней происходящих.
Понятие изолированной системы – идеализация, все реальные системы незамкнуты.
