
- •Оглавление
- •Часть I. Механика 4
- •Часть II. Молекулярная физика и термодинамика 81
- •Часть I. Механика
- •Кинематика
- •Основные понятия кинематики
- •З.2. Скорость
- •Среднее ускорение
- •Мгновенное ускорение
- •Ускорение точки при прямолинейном движении
- •Кинематика вращательного движения
- •4. Динамика
- •Закон всемирного тяготения
- •2). Сила тяжести
- •3). Сила реакции опоры
- •4). Сила трения
- •Виды трения
- •5). Сила упругости
- •4.4. Импульс. Закон сохранения импульса
- •История появления термина
- •4.5. Законы Ньютона
- •Замечания:
- •4.6. Энергия
- •Потенциальная энергия тела, поднятого над поверхностью Земли
- •Закон сохранения энергии в механике
- •4.7. Динамика вращательного движения
- •2). Пара сил
- •Момент импульса
- •Механический (классический) принцип относительности (принцип относительности Галилея)
- •Основы механики жидкостей и газов
- •Архимед из СиракузArchimedes of Siracuse, ок. 287–212 г. До н. Э.
- •Условие плавания тел
- •Вязкость газов
- •Часть II. Молекулярная физика и термодинамика
- •I. Молекулярная физика
- •1.1. Предмет молекулярной физики
- •1.2. Внесистемные единицы измерения величин в микрофизике физике
- •1.3. Основные положения молекулярно-кинетической теории строения вещества
- •1.4. Число степеней свободы молекул
- •1.5. Термодинамическая система. Термодинамические состояние и процесс
- •1.6. Статистический метод в молекулярной физике
- •1.7. Количество вещества. Масса молекул
- •1.8. Идеальный газ
- •1.9. Закон равномерного распределения энергии по степеням свободы молекул
- •1.10. Закон Максвелла25 о распределении молекул идеального газа по скоростям
- •Вывод распределения по Максвеллу
- •Границы применимости
- •Зависимость функции распределения Максвелла от температуры.
- •Характерные скорости Наиболее вероятная скорость
- •Средняя скорость
- •1.11. Основное уравнение молекулярно – кинетической теории (уравнение Клаузиуса26)
- •1.12. Уравнение Менделеева27 - Клапейрона28
- •1.13. Барометрическая формула. Распределение Больцмана
- •1.14. Средняя длина свободного пробега молекул
- •II. Термодинамика
- •2 .1. Термодинамический метод
- •2.2. Внутренняя энергия
- •Два способа изменения внутренней энергии. Теплота и работа
- •Первое начало термодинамики
- •Нулевое начало термодинамики
- •Теплоёмкость
- •1). Молярная теплоёмкость идеального газа при постоянном объёме
- •2). Молярная теплоёмкость идеального газа при постоянном давлении Уравнение Майера
- •Термический кпд для кругового процесса
- •Из истории тепловых двигателей
- •Цикл Карно38
- •Второе начало термодинамики
- •Энтропия
- •2.16. Статистическая интерпретация второго начала термодинамики
- •Реальные газы
- •Жидкости
- •Твёрдые тела
- •Изоморфизм и полиморфизм кристаллов
- •Кристаллические вещества Типы кристаллических решеток
- •Общая характеристика
- •Классификация решёток по симметрии
- •Объём ячейки
1.12. Уравнение Менделеева27 - Клапейрона28
Уравнение Менделеева – Клапейрона -–уравнение состояния идеального газа, устанавливающее связь между его объемом V, давлением P и абсолютной температурой T.
Рассматриваем идеальный газ. Уравнение состояния идеального газа:
P = n0 k T | V,
где V – объём газа.
Получаем: PV = n0V kT. Учтём, что N = n0V = Na – число частиц газа, где -–число молей газа, Na – постоянная Авогадро.
Тогда
получаем: PV
= NkT
=
Na
kT,
где Na
k
= R
= 8,31
 –
универсальная газовая постоянная.
–
универсальная газовая постоянная.
Окончательно получаем: PV= RT.
Последнее уравнение является уравнением состояния идеального газа и называется уравнением Менделеева – Клапейрона.
Частные случаи уравнения Менделеева – Клапейрона
Рассматриваем идеальный газ постоянной массы (m = const):
Изотермический процесс – процесс, протекающий в системе постоянной массы при постоянной температуре (T=const).
Процесс описывается законом Бойля29- Мариотта30: произведение объёма данной массы газа на его давление постоянно при постоянной температуре: PV=const.
Изобарный процесс – процесс, протекающий в системе постоянной массы при постоянном давлении (P=const).
Процесс описывается законом Гей – Люссака31: отношение объёма данной массы газа его абсолютной температуре при постоянном давлении есть величина постоянная:

Изохорный процесс – процесс, протекающий в системе постоянной массы при постоянном объёме (V = const).
Процесс описывается законом Шарля32 : отношение давление данной массы газа при постоянном объемё его абсолютной температуре есть величина постоянная:

Закон Дальтона33
В состоянии теплового равновесия давление в смеси идеальных газов равно сумме давлений каждой компоненты смеси:
P
= P1
+ P2
+ … +Pn
=

1.13. Барометрическая формула. Распределение Больцмана
Барометрическая формула — зависимость давления или плотности газа от высоты в поле силы тяжести.
Рассмотрим идеальный газ в равновесном состоянии внутри куба с ребром l. Давление газа на рани куба обусловлено ударами молекул. Молекулы находятся в однородном поле тяготения, температура постоянна, масса всех молекул одинакова.
Действительно, молекулы любого газа в реальности находятся в поле тяготения Земли.
Тяготение и тепловое движение приводят газ в состояние, при котором его концентрация и давление убывают с высотой.
Если
считать, что плотность газа по всему
объёму постоянна ( то
аэростатическое давление на глубине h
, будет равно:
то
аэростатическое давление на глубине h
, будет равно:
P
=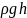 ,
(1)
,
(1)
где g – ускорение свободного падения.
Формулой (1) можно пользоваться для вычисления давления очень тонких горизонтальных слоёв газа.
Пусть P – давление газа на высоте h. Тогда с увеличением высоты на бесконечно малую величину dh давление понизится на величину:
dP
=
 (2)
(2)
Из
уравнения Менделеева – Клапейрона
следует, что плотность газа равна:
 .
(3)
.
(3)
Тогда:
dP
=
 (4)
(4)
или
 =
=
 .
(5)
.
(5)
Проинтегрируем (5) от 0 до h (при T = const):
 =
=
 ,
где P0
– давление на высоте h
= 0.
,
где P0
– давление на высоте h
= 0.
Тогда барометрическая формула примет вид:
P
= P0 ,
,
(6)
h
=
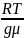 ln
ln .
.
Давление газа связано с концентрацией молекул:
P= n0 k T, (7)
где n0 – число молекул в единице объёма (концентрация молекул).
При T = const, получим:
=
 ,
(8)
,
(8)
где n00 – концентрация молекул при давлении Р0 (при h = 0).
Тогда уравнение (6) примет вид:
Так
как
 =
=
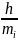 ,
где П
= mi
g
h
– потенциальная
энергия молекулы в поле тяготения Земли.
,
где П
= mi
g
h
– потенциальная
энергия молекулы в поле тяготения Земли.
Получаем распределение Больцмана:
Т.е. при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
При Т , то n0 n00 , т.е. повышение температуры ведёт к выравниванию концентрации молекул газа по объёму.
Если Т 0 К, то n0 0, т.е. все молекулы под действием силы тяжести будут опускаться на дно сосуда.
Атмосфера Земли существует лишь вследствие теплового движения частиц воздуха.
Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
Барометрическая
формула показывает, что плотность газа
уменьшается с высотой по экспоненциальному
закону. Чем выше температура
![]() ,
тем медленнее убывает плотность с
высотой. С другой стороны, возрастание
силы тяжести mg
(при неизменной температуре) приводит
к значительно большему уплотнению
нижних слоев и увеличению перепада
(градиента) плотности. Действующая на
частицы сила тяжести mg
может изменяться за счёт двух величин:
ускорения g и массы
частиц m. Следовательно,
в смеси газов, находящейся в поле тяжести,
молекулы различной массы по-разному
распределяются по высоте (рис. 115). На
рис. 115 показана зависимость концентрации
различных газов от высоты. Видно, что
число более тяжелых молекул с высотой
убывает быстрее, чем легких.
,
тем медленнее убывает плотность с
высотой. С другой стороны, возрастание
силы тяжести mg
(при неизменной температуре) приводит
к значительно большему уплотнению
нижних слоев и увеличению перепада
(градиента) плотности. Действующая на
частицы сила тяжести mg
может изменяться за счёт двух величин:
ускорения g и массы
частиц m. Следовательно,
в смеси газов, находящейся в поле тяжести,
молекулы различной массы по-разному
распределяются по высоте (рис. 115). На
рис. 115 показана зависимость концентрации
различных газов от высоты. Видно, что
число более тяжелых молекул с высотой
убывает быстрее, чем легких.

Рис. 115.
Реальное распределение давления и плотности воздуха в земной атмосфере не следует барометрической формуле, так как в пределах атмосферы температура и ускорение свободного падения меняются с высотой и географической широтой. Кроме того, атмосферное давление увеличивается с концентрацией в атмосфере паров воды.
