
- •Оглавление
- •Часть I. Механика 4
- •Часть II. Молекулярная физика и термодинамика 81
- •Часть I. Механика
- •Кинематика
- •Основные понятия кинематики
- •З.2. Скорость
- •Среднее ускорение
- •Мгновенное ускорение
- •Ускорение точки при прямолинейном движении
- •Кинематика вращательного движения
- •4. Динамика
- •Закон всемирного тяготения
- •2). Сила тяжести
- •3). Сила реакции опоры
- •4). Сила трения
- •Виды трения
- •5). Сила упругости
- •4.4. Импульс. Закон сохранения импульса
- •История появления термина
- •4.5. Законы Ньютона
- •Замечания:
- •4.6. Энергия
- •Потенциальная энергия тела, поднятого над поверхностью Земли
- •Закон сохранения энергии в механике
- •4.7. Динамика вращательного движения
- •2). Пара сил
- •Момент импульса
- •Механический (классический) принцип относительности (принцип относительности Галилея)
- •Основы механики жидкостей и газов
- •Архимед из СиракузArchimedes of Siracuse, ок. 287–212 г. До н. Э.
- •Условие плавания тел
- •Вязкость газов
- •Часть II. Молекулярная физика и термодинамика
- •I. Молекулярная физика
- •1.1. Предмет молекулярной физики
- •1.2. Внесистемные единицы измерения величин в микрофизике физике
- •1.3. Основные положения молекулярно-кинетической теории строения вещества
- •1.4. Число степеней свободы молекул
- •1.5. Термодинамическая система. Термодинамические состояние и процесс
- •1.6. Статистический метод в молекулярной физике
- •1.7. Количество вещества. Масса молекул
- •1.8. Идеальный газ
- •1.9. Закон равномерного распределения энергии по степеням свободы молекул
- •1.10. Закон Максвелла25 о распределении молекул идеального газа по скоростям
- •Вывод распределения по Максвеллу
- •Границы применимости
- •Зависимость функции распределения Максвелла от температуры.
- •Характерные скорости Наиболее вероятная скорость
- •Средняя скорость
- •1.11. Основное уравнение молекулярно – кинетической теории (уравнение Клаузиуса26)
- •1.12. Уравнение Менделеева27 - Клапейрона28
- •1.13. Барометрическая формула. Распределение Больцмана
- •1.14. Средняя длина свободного пробега молекул
- •II. Термодинамика
- •2 .1. Термодинамический метод
- •2.2. Внутренняя энергия
- •Два способа изменения внутренней энергии. Теплота и работа
- •Первое начало термодинамики
- •Нулевое начало термодинамики
- •Теплоёмкость
- •1). Молярная теплоёмкость идеального газа при постоянном объёме
- •2). Молярная теплоёмкость идеального газа при постоянном давлении Уравнение Майера
- •Термический кпд для кругового процесса
- •Из истории тепловых двигателей
- •Цикл Карно38
- •Второе начало термодинамики
- •Энтропия
- •2.16. Статистическая интерпретация второго начала термодинамики
- •Реальные газы
- •Жидкости
- •Твёрдые тела
- •Изоморфизм и полиморфизм кристаллов
- •Кристаллические вещества Типы кристаллических решеток
- •Общая характеристика
- •Классификация решёток по симметрии
- •Объём ячейки
Зависимость функции распределения Максвелла от температуры.
Хотя уравнение Мааксвелла дает распределение скоростей, или, другими словами, долю молекул, имеющих специфическую скорость, часто более интересны другие величины, такие как средние скорости частиц. В следующих подразделах мы определим и получим наиболее вероятную скорость, среднюю скорость и среднеквадратичную скорость.
Характерные скорости Наиболее вероятная скорость
Наиболее вероятная скорость, — вероятность обладания которой любой молекулой системы максимальна, и которая соответствует максимальному значению f( ).
Чтобы
найти её, необходимо вычислить
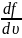 ,
приравнять её нулю и решить
,
приравнять её нулю и решить
относительно
:
 =
=
 [4
]
= 0.
[4
]
= 0.
В
итоге получим:
=
 =
=
 , где R
= 8,31
, где R
= 8,31
 – универсальная газовая постоянная,
– молярная масса газа, k
– постоянная Больцмана, mi
– масса молекулы газа, Т
– температура газа.
– универсальная газовая постоянная,
– молярная масса газа, k
– постоянная Больцмана, mi
– масса молекулы газа, Т
– температура газа.
Средняя скорость
Подставляя
f( и интегрируя, мы получим:
и интегрируя, мы получим:
<
=
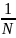
 =
=
 => <
=> < =
=
 .
.
Среднеквадратичная скорость
Подставляя f( и интегрируя, мы получим:
< =
=
 =
=
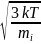 .
.
Т.о., скорости, которые характеризуют состояние газа:
1) наиболее вероятная = = ,
2) средняя < = = 1,13 ,
3)средняя
квадратичная =
=1,22
=
=1,22

Экспериментальная проверка закона распределения Максвелла -– опыт Штерна
В доль
оси внутреннего цилиндра с целью натянута
платиновая проволока, покрытая слоем
серебра, которая нагревается током.
При нагревании серебро испаряется,
атомы серебра вылетают через щель и
попадают на внутреннюю поверхность
второго цилиндра. Если оба цилиндра
неподвижны, то все атомы независимо от
их скорости попадают в одно и то же место
В (рис. 113).
доль
оси внутреннего цилиндра с целью натянута
платиновая проволока, покрытая слоем
серебра, которая нагревается током.
При нагревании серебро испаряется,
атомы серебра вылетают через щель и
попадают на внутреннюю поверхность
второго цилиндра. Если оба цилиндра
неподвижны, то все атомы независимо от
их скорости попадают в одно и то же место
В (рис. 113).
Рис.113.
При вращении цилиндров с угловой скоростью ω атома серебра попадут в точки В’, B’’ и так далее. По величине ω, расстоянию l и смещению х = ВВ’ можно вычислить скорость атомов, попавших в точку В’.
x
=
 RII;
=
RII;
=
 RII.
RII.
Изображение щели получается размытым. Исследуя толщину осаждённого слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
1.11. Основное уравнение молекулярно – кинетической теории (уравнение Клаузиуса26)
Рассмотрим идеальный газ в равновесном состоянии, вне силовых полей внутри куба с ребром l. Давление газа на грани куба обусловлен6о ударами молекул.
Упрощённое доказательство уравнения
Молекулы движутся беспорядочно, поэтому все направления их движения равновероятны: N молекул из их общего числа N будет двигаться между каждыми двумя гранями куба.
Обозначим: mi –масса молекулы, -–скорость молекулы, ∆t – время удара молекулы о стенку, k – количество ударов i - той молекулы о стенку за некоторое время t; - время между двумя последовательными соударениями молекулы со стенкой.
Считаем
молекулы классическими частицами, удары
молекул о стенку упругими. По второму
закону Ньютона сила удара i
– той молекулы о стенку (рис. 114):
fi
=
 .
(1)
.
(1)
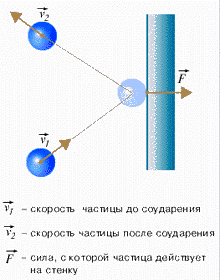
Рис. 114.
За время t молекула ударит о стенку k раз и передаст ей импульс (2mi k).
Средняя сила, действующая на стенку со стороны i - той молекулы:
<Fi
>
= k
 ,
(2)
,
(2)
где
k
=
 =
=
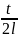 ,
т.к.
=
,
т.к.
=
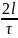 .
.
Получаем:
<Fi
>
=
 .
.
Средняя (за время t) сила давления i – той молекулы на стенку:
<Fi>
=
 .
(3)
.
(3)
Т.к. разные молекулы движутся с различными скоростями, то давление со стороны всей совокупности молекул, движущихся между двумя противоположными стенками:
<F>
=
 +
+
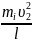 + … +
+ … +
 .
(4)
.
(4)
Т.к. n = N – число молекул, движущихся между двумя противоположными гранями куба, то (4) примет вид:
<F>
=
 =
=
=
=
 ,
,
или
<F>
=
 |:
|:
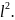 (5)
(5)
Получим:
 =
=
 (6)
(6)
где l2 – площадь грани куба, l3 - объём куба.
Тогда
(6) примет вид: P
=
n0
mi
P
=
 n0
n0
 ,
(7)
,
(7)
где <Eк> = – средняя кинетическая энергия поступательного движения молекул.
Тогда уравнение (7) примет вид:
P = n0 <Eк>. (8)
Уравнение (8) – основное уравнение МКТ (уравнение Клаузиуса):
давление идеального газа прямо пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
Учтём,
что
 .
(9)
.
(9)
Подставив
(9) в (7), получим: P=
n0
 = n0kT,
= n0kT,
т.е. в итоге получаем: P= n0 k T. (10)
Уравнение (10) – уравнение состояния идеального газа:
давление идеального газа пропорционально концентрации молекул газа и его абсолютной температуры.
Из уравнений (9) и (8) следует: n0 <Eк> = n0 k T => <Eк> = k T,
т.е. абсолютная температура является мерой средней кинетической энергии теплового поступательного движения молекул.
