
- •Оглавление
- •Часть I. Механика 4
- •Часть II. Молекулярная физика и термодинамика 81
- •Часть I. Механика
- •Кинематика
- •Основные понятия кинематики
- •З.2. Скорость
- •Среднее ускорение
- •Мгновенное ускорение
- •Ускорение точки при прямолинейном движении
- •Кинематика вращательного движения
- •4. Динамика
- •Закон всемирного тяготения
- •2). Сила тяжести
- •3). Сила реакции опоры
- •4). Сила трения
- •Виды трения
- •5). Сила упругости
- •4.4. Импульс. Закон сохранения импульса
- •История появления термина
- •4.5. Законы Ньютона
- •Замечания:
- •4.6. Энергия
- •Потенциальная энергия тела, поднятого над поверхностью Земли
- •Закон сохранения энергии в механике
- •4.7. Динамика вращательного движения
- •2). Пара сил
- •Момент импульса
- •Механический (классический) принцип относительности (принцип относительности Галилея)
- •Основы механики жидкостей и газов
- •Архимед из СиракузArchimedes of Siracuse, ок. 287–212 г. До н. Э.
- •Условие плавания тел
- •Вязкость газов
- •Часть II. Молекулярная физика и термодинамика
- •I. Молекулярная физика
- •1.1. Предмет молекулярной физики
- •1.2. Внесистемные единицы измерения величин в микрофизике физике
- •1.3. Основные положения молекулярно-кинетической теории строения вещества
- •1.4. Число степеней свободы молекул
- •1.5. Термодинамическая система. Термодинамические состояние и процесс
- •1.6. Статистический метод в молекулярной физике
- •1.7. Количество вещества. Масса молекул
- •1.8. Идеальный газ
- •1.9. Закон равномерного распределения энергии по степеням свободы молекул
- •1.10. Закон Максвелла25 о распределении молекул идеального газа по скоростям
- •Вывод распределения по Максвеллу
- •Границы применимости
- •Зависимость функции распределения Максвелла от температуры.
- •Характерные скорости Наиболее вероятная скорость
- •Средняя скорость
- •1.11. Основное уравнение молекулярно – кинетической теории (уравнение Клаузиуса26)
- •1.12. Уравнение Менделеева27 - Клапейрона28
- •1.13. Барометрическая формула. Распределение Больцмана
- •1.14. Средняя длина свободного пробега молекул
- •II. Термодинамика
- •2 .1. Термодинамический метод
- •2.2. Внутренняя энергия
- •Два способа изменения внутренней энергии. Теплота и работа
- •Первое начало термодинамики
- •Нулевое начало термодинамики
- •Теплоёмкость
- •1). Молярная теплоёмкость идеального газа при постоянном объёме
- •2). Молярная теплоёмкость идеального газа при постоянном давлении Уравнение Майера
- •Термический кпд для кругового процесса
- •Из истории тепловых двигателей
- •Цикл Карно38
- •Второе начало термодинамики
- •Энтропия
- •2.16. Статистическая интерпретация второго начала термодинамики
- •Реальные газы
- •Жидкости
- •Твёрдые тела
- •Изоморфизм и полиморфизм кристаллов
- •Кристаллические вещества Типы кристаллических решеток
- •Общая характеристика
- •Классификация решёток по симметрии
- •Объём ячейки
1.8. Идеальный газ
Идеальный газ — математическая модель газа, в которой предполагается, что: 1) потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией; 2) суммарный объём молекул газа пренебрежимо мал; 3) между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги; 4) время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
В расширенной модели идеального газа частицы, из которого он состоит, имеют форму упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
Идеальный газ реально не существует.
1.9. Закон равномерного распределения энергии по степеням свободы молекул
Закон доказан Л.Больцманом24 методом классической статистической физики, исходя из предположения, что движение молекул подчиняется законам классической механики:
Для
статистической системы,
которая
находится в состоянии термодинамического
равновесия на каждую поступательную и
вращательную степени свободы молекулы
в среднем приходится одинаковая
кинетическая энергия,
равная
 kT,
kT,
где
k
= 1,38
10-23
 - постоянная Больцмана.
- постоянная Больцмана.
Если
молекула имеет i
степеней
свободы, то её средняя кинетическая
энергия равна: <
>
=
 kT.
kT.
Закон Больцмана лежит в основе всей теоpии идеальных газов. Однако, закон оказался неточным, т.к. молекулы – квантовые частицы.
1.10. Закон Максвелла25 о распределении молекул идеального газа по скоростям
Понятие о функции распределения
Фу́нкция распределе́ния в теории вероятностей — функция, характеризующая распределение случайной величины или случайного вектора; вероятность того, что случайная величина X примет значение, меньшее, чем х, где х — произвольное действительное число.
Функция распределения, основное понятие статистической физики; характеризует плотность вероятности распределения частиц статистической системы по фазовому пространству (т.е. по координатам (qi и импульсам pi) в классической статистической физике или вероятность распределения по квантовомеханическим состояниям в квантовой статистике.
Распределение Ма́ксвелла — распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию.
Функция распределения молекул идеального газа по скоростям
Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число dN молекул однородного (p = const) одноатомного идеального газа из общего числа N его молекул в единице объёма имеет при данной температуре Т скорости, заключенные в интервале от до + d .
Идеальный газ – система из большого числа свободных невзаимодействующих частиц, находящихся в непрерывном хаотическом движении, часто сталкивающихся друг с другом. Поэтому в газе при постоянных внешних параметрах устанавливается равновесное состояние, которому соответствует определённое распределение частиц в пространстве по направлениям движения и скоростям. При равновесии средние скорости и число частиц, движущихся в разных направлениях, оказывается одинаковым, о чём свидетельствует отсутствие направленного потока газа при равновесии.
Абсолютная величина скорости молекул, а также проекции скорости на любую ось могут принимать непрерывные значения от нуля до бесконечности. Значит, должна существовать непрерывная функция распределения скоростей f( ), показывающая относительное количество молекул, движущихся в единичном интервале скоростей со скоростью, близкой к скорости .
На языке теории вероятности d есть плотность вероятности того, что молекула имеет скорость, лежащую в интервале от до + d . Тогда сама вероятность описывается выражением: dW = f( ) •d .
Нахождение функции распределения f( ) молекул по скоростям является главной задачей молекулярно-кинетической теории. Это объясняется тем, что согласно теории вероятности любой функции F( ) (это может быть внутренняя энергия, длина свободного пробега или любая другая функция состояния газа) определяется следующим интегралом:
<
F(
)>
=
 f(
)
•d
.
f(
)
•d
.
Впервые найти функцию распределения по скоростям удалось Д.Максвеллу, который исходил из следующих предположений:
Идеальный газ состоит из большого числа N одинаковых молекул;
Температура газа постоянна (T= const);
Молекулы газа совершают тепловое хаотическое движение;
На газ не действуют силовые поля.
Функция
распределения молекул по скоростям f
)=
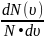 определяет
относительное число молекул
, скорости
которых лежат в интервале от
до
+ d
.
определяет
относительное число молекул
, скорости
которых лежат в интервале от
до
+ d
.
Используя методы теории вероятностей, Максвелл нашел функцию f ( ) -–закон распределения молекул идеального газа по скоростям:
f(
)
= 4
( )3/2
2
еxp
{
)3/2
2
еxp
{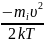 },
},
где f( ) зависит от рода газа (mi – масса молекулы) и от параметров состояния (температуры Т).
