
- •Оглавление
- •Часть I. Механика 4
- •Часть II. Молекулярная физика и термодинамика 81
- •Часть I. Механика
- •Кинематика
- •Основные понятия кинематики
- •З.2. Скорость
- •Среднее ускорение
- •Мгновенное ускорение
- •Ускорение точки при прямолинейном движении
- •Кинематика вращательного движения
- •4. Динамика
- •Закон всемирного тяготения
- •2). Сила тяжести
- •3). Сила реакции опоры
- •4). Сила трения
- •Виды трения
- •5). Сила упругости
- •4.4. Импульс. Закон сохранения импульса
- •История появления термина
- •4.5. Законы Ньютона
- •Замечания:
- •4.6. Энергия
- •Потенциальная энергия тела, поднятого над поверхностью Земли
- •Закон сохранения энергии в механике
- •4.7. Динамика вращательного движения
- •2). Пара сил
- •Момент импульса
- •Механический (классический) принцип относительности (принцип относительности Галилея)
- •Основы механики жидкостей и газов
- •Архимед из СиракузArchimedes of Siracuse, ок. 287–212 г. До н. Э.
- •Условие плавания тел
- •Вязкость газов
- •Часть II. Молекулярная физика и термодинамика
- •I. Молекулярная физика
- •1.1. Предмет молекулярной физики
- •1.2. Внесистемные единицы измерения величин в микрофизике физике
- •1.3. Основные положения молекулярно-кинетической теории строения вещества
- •1.4. Число степеней свободы молекул
- •1.5. Термодинамическая система. Термодинамические состояние и процесс
- •1.6. Статистический метод в молекулярной физике
- •1.7. Количество вещества. Масса молекул
- •1.8. Идеальный газ
- •1.9. Закон равномерного распределения энергии по степеням свободы молекул
- •1.10. Закон Максвелла25 о распределении молекул идеального газа по скоростям
- •Вывод распределения по Максвеллу
- •Границы применимости
- •Зависимость функции распределения Максвелла от температуры.
- •Характерные скорости Наиболее вероятная скорость
- •Средняя скорость
- •1.11. Основное уравнение молекулярно – кинетической теории (уравнение Клаузиуса26)
- •1.12. Уравнение Менделеева27 - Клапейрона28
- •1.13. Барометрическая формула. Распределение Больцмана
- •1.14. Средняя длина свободного пробега молекул
- •II. Термодинамика
- •2 .1. Термодинамический метод
- •2.2. Внутренняя энергия
- •Два способа изменения внутренней энергии. Теплота и работа
- •Первое начало термодинамики
- •Нулевое начало термодинамики
- •Теплоёмкость
- •1). Молярная теплоёмкость идеального газа при постоянном объёме
- •2). Молярная теплоёмкость идеального газа при постоянном давлении Уравнение Майера
- •Термический кпд для кругового процесса
- •Из истории тепловых двигателей
- •Цикл Карно38
- •Второе начало термодинамики
- •Энтропия
- •2.16. Статистическая интерпретация второго начала термодинамики
- •Реальные газы
- •Жидкости
- •Твёрдые тела
- •Изоморфизм и полиморфизм кристаллов
- •Кристаллические вещества Типы кристаллических решеток
- •Общая характеристика
- •Классификация решёток по симметрии
- •Объём ячейки
1.6. Статистический метод в молекулярной физике
Молекулярно-кинетическая теория (МКТ) ставит целью исследовать макроскопические свойства тел, которые непосредственно наблюдаются на опыте (давление, температура и т.п.), как суммарный результат действия молекул.
В МКТ термодинамические системы – системы, состоящие из большого числа частиц. Поэтому МКТ пользуется статистическим методом, интересуясь не движением отдельных молекул, а лишь средними величинами, которые характеризуют движение их огромной совокупности:
1).
Средняя
скорость:
< =
=
 =
=
 ,
,
где
 -–скорость i-той
молекулы, N
–
число молекул.
-–скорость i-той
молекулы, N
–
число молекул.
2). Средняя квадратичная скорость:
< =
= =
=
 .
.
3). Средняя энергия < >.
Поэтому МКТ называют также статистической физикой.
В классической статистической физике молекулы рассматриваются как классические частицы, движение которых подчиняется законам классической механике, в т.ч. второму закону Ньютона.
1.7. Количество вещества. Масса молекул
Количество
вещества (n, —
физическая
величина,
характеризующая количество однотипных
структурных единиц, содержащихся в
веществе.
—
физическая
величина,
характеризующая количество однотипных
структурных единиц, содержащихся в
веществе.
Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в Международной системе единиц (СИ) — моль.
Эта физическая величина используется для измерения макроскопических количеств веществ в тех случаях, когда для численного описания изучаемых процессов необходимо принимать во внимание микроскопическое строение вещества, например, в химии, при изучении процессов электролиза, или в термодинамике, при описании уравнений состояния идеального газа.
При описании химических реакций, количество вещества является более удобной величиной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам.
Например, для реакции горения водорода (2H2 + O2 → 2H2O) требуется в два раза большее количество вещества водорода, чем кислорода. При этом масса водорода, участвующего в реакции, примерно в 8 раз меньше массы кислорода (так как атомная масса водорода примерно в 16 раз меньше атомной массы кислорода). Таким образом, использование количества вещества облегчает интерпретацию уравнений реакций: соотношение между количествами реагирующих веществ непосредственно отражается коэффициентами в уравнениях.
Так как использовать в расчётах непосредственно количество молекул неудобно, потому что это число в реальных опытах слишком велико, вместо измерения количества молекул «в штуках», их измеряют в молях.
Моль
– количество вещества,
содержащее
столько же молекул (атомов,
ионов),
сколько
атомов содержится в
0,012 кг изотопа
углерода
 .
.
Число
частиц, содержащихся в моле
вещества называется постоянной
Авогадро23:
Na
= 6,02
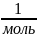 .
.
В моле любого вещества (твёрдого, жидкого, газообразного) содержится одинаковое количество молекул, равное Na.
Моль -– это количество вещества, содержащее 6,02·1023 атомов или молекул этого вещества.
Так как массы различных молекул отличны друг от друга, то одинаковые количества различных веществ имеют разную массу.
Массу
моля
называют молярной
массой:
 ,
,
 ,
где m
– масса вещества.
,
где m
– масса вещества.
Относительная
молекулярная масса Mr
– величина
безразмерная: Mr
=
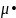 103.
103.
Если mi – масса одной i – той молекулы, то = mi• Na.
Число молекул, содержащихся в произвольной массе вещества:
N = • Na.
По закону Авогадро, количество газообразного вещества так же можно определить на основании его объёма: = V / Vm, где V — объём газа (при нормальных условиях), Vm — молярный объём газа при н. у., равный 22,4 л/моль.
Таким образом, справедлива формула, объединяющая основные расчёты с количеством вещества:
=
 =
=
 =
=
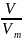
Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой -–если вещество состоит не из молекул, а из атомов). В таблице 1 для иллюстрации приведены молярные массы М для нескольких веществ разного строения.
Таблица 1. Молярные массы различных веществ
-
Вещество
Молекулярная или атомная масса (округлена)
молярная масса
•10-3
Вода Н2О
18 а.е.м.
18 кг/моль
СаО
56 а.е.м.
56 кг/моль
Углерод 12С
12 а.е.м.
12 кг/моль
Медь Cu
63,5 a.e.м.
63,5 кг/моль
Молекула хлора Cl2
71 а.е.м.
71 кг/моль
Количественно масса 1 моль вещества – масса вещества в граммах, численно равная его атомной или молекулярной массе.
Пример: молекулярная масса воды H2O равна 18 а.е.м. (атомная масса водорода -–1, кислорода – 16, итого 1+1+16=18). Значит, один моль воды равен по массе 18 граммов, и эта масса воды содержит 6,02·1023 молекул воды.
Итак, один моль любого вещества содержит 6,02 · 1023 молекул, атомов или других частиц.
Например, 1 моль воды H2O содержит 6 · 1023 молекул H2O;
1 моль железа Fe содержит 6 · 1023 атомов Fe.
1 моль хлора Cl2 содержит 6 · 1023 молекул Cl2.
В то же время 1 моль хлора Cl2 содержит 2 моль атомов хлора Cl.
