
- •Оглавление
- •Часть I. Механика 4
- •Часть II. Молекулярная физика и термодинамика 81
- •Часть I. Механика
- •Кинематика
- •Основные понятия кинематики
- •З.2. Скорость
- •Среднее ускорение
- •Мгновенное ускорение
- •Ускорение точки при прямолинейном движении
- •Кинематика вращательного движения
- •4. Динамика
- •Закон всемирного тяготения
- •2). Сила тяжести
- •3). Сила реакции опоры
- •4). Сила трения
- •Виды трения
- •5). Сила упругости
- •4.4. Импульс. Закон сохранения импульса
- •История появления термина
- •4.5. Законы Ньютона
- •Замечания:
- •4.6. Энергия
- •Потенциальная энергия тела, поднятого над поверхностью Земли
- •Закон сохранения энергии в механике
- •4.7. Динамика вращательного движения
- •2). Пара сил
- •Момент импульса
- •Механический (классический) принцип относительности (принцип относительности Галилея)
- •Основы механики жидкостей и газов
- •Архимед из СиракузArchimedes of Siracuse, ок. 287–212 г. До н. Э.
- •Условие плавания тел
- •Вязкость газов
- •Часть II. Молекулярная физика и термодинамика
- •I. Молекулярная физика
- •1.1. Предмет молекулярной физики
- •1.2. Внесистемные единицы измерения величин в микрофизике физике
- •1.3. Основные положения молекулярно-кинетической теории строения вещества
- •1.4. Число степеней свободы молекул
- •1.5. Термодинамическая система. Термодинамические состояние и процесс
- •1.6. Статистический метод в молекулярной физике
- •1.7. Количество вещества. Масса молекул
- •1.8. Идеальный газ
- •1.9. Закон равномерного распределения энергии по степеням свободы молекул
- •1.10. Закон Максвелла25 о распределении молекул идеального газа по скоростям
- •Вывод распределения по Максвеллу
- •Границы применимости
- •Зависимость функции распределения Максвелла от температуры.
- •Характерные скорости Наиболее вероятная скорость
- •Средняя скорость
- •1.11. Основное уравнение молекулярно – кинетической теории (уравнение Клаузиуса26)
- •1.12. Уравнение Менделеева27 - Клапейрона28
- •1.13. Барометрическая формула. Распределение Больцмана
- •1.14. Средняя длина свободного пробега молекул
- •II. Термодинамика
- •2 .1. Термодинамический метод
- •2.2. Внутренняя энергия
- •Два способа изменения внутренней энергии. Теплота и работа
- •Первое начало термодинамики
- •Нулевое начало термодинамики
- •Теплоёмкость
- •1). Молярная теплоёмкость идеального газа при постоянном объёме
- •2). Молярная теплоёмкость идеального газа при постоянном давлении Уравнение Майера
- •Термический кпд для кругового процесса
- •Из истории тепловых двигателей
- •Цикл Карно38
- •Второе начало термодинамики
- •Энтропия
- •2.16. Статистическая интерпретация второго начала термодинамики
- •Реальные газы
- •Жидкости
- •Твёрдые тела
- •Изоморфизм и полиморфизм кристаллов
- •Кристаллические вещества Типы кристаллических решеток
- •Общая характеристика
- •Классификация решёток по симметрии
- •Объём ячейки
1.4. Число степеней свободы молекул
В механике вводилось понятие числа степеней свободы: это число независимых переменных (координат), которые полностью определяют положение системы в пространстве.
Молекула одноатомного газа, которую можно рассматривать как материальную точку (рис. 110 а), имеет три поступательные степени свободы і = 3, так как для описания положения такой молекулы газа в пространстве достаточно трёх координат (х, у, z). При этом не учитывается энергия вращательного движения.
В механике молекула двухатомного газа в первом приближении считается совокупностью двух материальных точек, которые жестко связанны недеформируемой связью (рис. 110, б). Жесткой связью называется связь, при которой расстояние между атомами не изменяется. Двухатомные молекулы с жесткой связью (N2, O2, Н2) имеют iпост. = 3 поступательные степени свободы и iвр. = 2 вращательные степени свободы: i = iпост +iвр = 3 + 2=5.
У трехатомной (рис. 110, в) и многоатомной нелинейной молекулы шесть степеней свободы: три поступательных и три вращательных. Поступательные степени свободы связаны с движением молекулы как целого в пространстве, вращательные -–с поворотом молекулы как целого. Вращение относительного осей координат x и z приведет к изменению положения молекул в пространстве, при вращении относительно оси у молекула не изменяет своё положение. Трехатомная молекула с жёсткой связью обладает 6 степенями свободы (iпост = 3; iвр = 3):
i = iпост +iвр = 3 + 3 = 6.
Естественно считать, что жесткой связи между атомами не существует. Поэтому необходимо учитывать для реальных молекул также степени свободы колебательного движения. Если связь между атомами не жесткая, то добавляются колебательные степени свободы. Для нелинейной молекулы ікол. = 3N -–6, где N -–число атомов в молекуле.
Мы будем рассматривать молекулы с жесткой связью, поэтому :
![]() .
.

Рис. 110.
1.5. Термодинамическая система. Термодинамические состояние и процесс
Термодинамической системой называется совокупность макроскопических тел, которые могут обмениваться энергией как друг с другом, так и с внешней средой.
Термодинамические параметры – это физические величины, характеризующие термодинамическое состояние системы.
Основные термодинамические параметры:
1). Объём
Объём V(м3) – очевидный параметр.
Иногда
используют понятие «удельный
объем»
тела – величина, равная отношению объёма
к его массе:
=
 ,
,
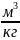 .
Величина, обратная удельному объёму
называется плотностью тела:
=
,
.
.
Величина, обратная удельному объёму
называется плотностью тела:
=
,
.
2). Давление
Давлением
Р –
называется
скалярная величина, равная, отношению
нормально направленной силы Fn
к площади поверхности S,
на которую действует эта сила:
P
=
 ,
Па.
,
Па.
В МКТ давление – это усреднённая сила удара молекул о стенки сосуда.
3). Температура
Температура характеризует степень нагретости тел, является мерой интенсивности теплового движения молекул (атомов) тела.
В СИ термодинамическая (абсолютная) температура Т измеряется в Кельвинах: Т = (t0C + 273,15), К.
Абсолютный нуль температур Т = 0 К на практике не достижим.
Во всех частях термодинамической системы, находящейся в равновесии, температура одинакова.
Другие термодинамические параметры: плотность, теплоёмкость, удельное электросопротивление и др.
Два состояния системы считаются разными, если для них неодинаковы значения хотя бы одного из термодинамических параметров.
Равновесное состояние (состояние термодинамического равновесия) – состояние системы, при котором все её параметры остаются неизменными при неизменных внешних параметрах сколь угодно долго.
Если какой-то параметр системы изменяет своё значение, то состояние будет неравновесным.
Понятие «равновесное состояние» - идеализация.
Термодинамическим процессом называется процесс изменения состояния термодинамической системы.
Всякий термодинамический процесс связан с нарушением равновесия системы. Однако, если этот процесс протекает бесконечно медленно, то такой процесс можно считать практически равновесным (квазистатическим).
Все реальные процессы неравновесные, т.к. протекают с конечной скоростью.
Виды термодинамических процессов
Изопроцессы – это термодинамические процессы, происходящие в системе с постоянной массой (m = const) при каком-либо постоянном параметре:
T = const – изотермический;
V = const – изохорический (изохорный);
P = const – изобарический (изобарный).
Адиабатический
(адиабатный)
процесс
– процесс,
который происходит в термодинамической
системе без теплообмена с внешними
телами ( .
.
Адиабатный процесс – идеализация, их реально не существует. Однако многие быстро протекающие процессы можно считать практически адиабатными, т.к. за время такого процесса существенный теплообмен с внешней средой произойти не успевает.
