
- •Содержание
- •Основные физико-химические характеристики элементов.
- •Важнейшие соединения ионов магния и кальция.
- •Испытания на подлинность ионов магния
- •Испытание на подлинность ионов кальция.
- •Количественное определение ионов магния и кальция.
- •Определение солей магния.
- •Определение солей кальция.
- •Биологическая роль магния.
- •Биологическая роль кальция
- •Лекарственные препараты магния и кальция
- •Приложения (фармакопейные статьи).
- •Магния сульфат (фс 42-0253-07)
- •Кальция глюконат (фс 42-0238-07)
- •Список литературы
Петрозаводский Государственный Университет
РЕФЕРАТ
на тему
СОЛИ КАЛЬЦИЯ И МАГНИЯ


Выполнила студентка III курса
медицинского факультета
Коновалова Ю.
Петрозаводск
Содержание
ОСНОВНЫЕ ФИЗИКО-ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ЭЛЕМЕНТОВ
ВАЖНЕЙШИЕ СОЕДИНЕНИЯ ИОНОВ МАГНИЯ И КАЛЬЦИЯ
ИСПЫТАНИЯ НА ПОДЛИННОСТЬ ИОНОВ МАГНИЯ
ИСПЫТАНИЯ НА ПОДЛИННОСТЬ ИОНОВ КАЛЬЦИЯ
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ИОНОВ МАГНИЯ И КАЛЬЦИЯ
БИОЛОГИЧЕСКАЯ РОЛЬ МАГНИЯ
БИОЛОГИЧЕСКАЯ РОЛЬ КАЛЬЦИЯ
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ МАГНИЯ И КАЛЬЦИЯ
ПРИЛОЖЕНИЯ
СПИСОК ЛИТЕРАТУРЫ
Основные физико-химические характеристики элементов.
Ма́гний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Атомная масса 24,304. Фармакопейная статья ФС 42-0253-07.
Ка́льций — элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20. Обозначается символом Ca (лат. Calcium). Атомная масса 40,078. Фармакопейная статья ФС 42-0238-07.
Магний и кальций обладают ярко выраженными металлическими свойствами, поэтому в организме данные элементы присутствуют в виде ионов Ca2+ и Mg2+.
Важнейшие соединения ионов магния и кальция.
В медицинской практике наибольшее значение имеют магния окись и магния сульфат.
Лекарственное вещество |
Химическая формула |
Описание |
Магния окись Magnesii oxydum |
MgO |
Белый мелкий легкий порошок без запаха |
Магния сульфат Magnesii sulfas |
MgSO4 * 7H2O |
Бесцветные призматические выветривающиеся кристаллы |
Магния оксид и магния сульфат различаются по физико-химическим свойствам. Магния оксид практически нерастворим в воде (свободной от примеси углекислого газа) и в этаноле, но растворим в разведенных кислотах. Магния сульфат легко растворим в воде, практически не растворим в этаноле.
В медицинской практике наиболее применяют кальция хлорид, а хирургической и стоматологической практике применяют кальция сульфат жженый.
Лекарственное вещество |
Химическая формула |
Описание |
Кальция хлорид Calcii Chloridum |
CaCl2 * 6H2O |
Бесцветные кристаллы без запаха, горько-соленого вкуса, очень гигроскопичные, расплываются на воздухе, переходя при 34 0С в дигидрат (CaCl2*2H2O) |
Кальция сульфат жженый Calcii sulfas ustus |
CaSO4 * 2H2O |
Сухой, мелкий, аморфный порошок белого или слегка сероватого цвета. Мало растворим в воде (1:600) в воде, водный раствор имеет нейтральную реакцию. |
Испытания на подлинность ионов магния
Соли магния образуют с раствором натрия гидрофосфата в присутствии аммония хлорида белый кристаллический осадок магний-аммоний фосфата, растворимый в кислоте уксусной:
Mg2+ + Na2HPO4 + NH3 MgNH4PO4↓ + 2Na+
Для предупреждения образования осадка магния гидроксида к реакционной смеси добавляют аммония хлорид, избытка которого, однако, следует избегать вследствие образования растворимых комплексных ионов [MgCl3]- и [MgCl4]2-.
Методика:
В пробирку вносят по одной капле растворов соли магния, аммония хлорида и концентрированного раствора аммиака. Каплю смеси наносят на предметное стекло и рядом помещают каплю раствора натрия гидрофосфата. Приводят капли в соприкосновение и через 1-3 минуты наблюдают под микроскопом образование прозрачных бесцветных кристаллов магний-аммония фосфата.

Гидроксиды натрия, калия и аммония образуют с катионом Mg2+ белый аморфный осадок гидроксида магния Mg(OH)2, растворимого в кислотах и солях аммония:
Mg2+ + 2OH- Mg(OH)2↓
Mg2+ + 2NH3 * H2O Mg(OH)2↓ + 2NH4+
Образование нерастворимого гидроксида действием раствора аммиака, отличает катион Mg2+ от катиона Ca2+, который не даст реакцию с гидроксидом аммония.
Методика:
В две пробирки вносят по 5-6 капель раствора соли магния и прибавляют по каплям: в одну – раствор натрия гидроксида (или калия), в другую – раствор аммиака до выпадения белого аморфного осадка. При реакции с аммиаком достигается неполное осаждение катионов магния в виде Mg(OH)2, так как гидроксид магния частично растворяется в растворах солей аммония (особенно – в концентрированных).
Реакция с магнезоном I (с пара-нитробензолазорезорцином). В щелочной среде магнезон I, имеющий красную окраску, образует с катионами Mg2+ комплекс синего цвета, сорбирующийся на осадке гидроксида магния. Предположительно реакцию можно описать схемой:

Методика:
На предметное стекло наносят каплю раствора соли магния и прибавляют каплю щелочного раствора магнезона I. Образуется синий осадок. При малых концентрациях катиона магния осадок не выделяется, а раствор окрашивается в синий цвет.
Реакция с 8-оксихинолином. Катионы Mg2+ образуют с 8-оксихинолином в аммиачной среде при рН от 8 до 13 (лучше – при нагревании) желто-зеленый кристаллический осадок внутрикомплексного соединения – оксихинолината мания:
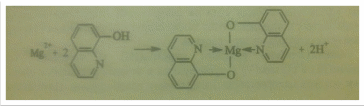
Осадок оксихинолината магния растворим в минеральных кислотах и в уксусной кислоте.
Методика:
В пробирку вносят 2-3 капли раствора соли магния, 2 капли раствора аммиака и прибавляют по каплям раствор хлорида аммония до первоначально выпавшего белого осадка гидроксида магния Mg(OH)2. К полученному раствору по каплям прибавляют раствор 8-оксихинолина до выпадения желто-зеленого осадка оксихинолината магния.
Реакция с хинализарином (1,2,5,8-тетраоксиантрахинон). Катион Mg2+ при взаимодействии с хинализарином в щелочной среде дает синий осадок комплексного соединения – хинализарината магния состава MgL(OH), где HL – условное обозначение молекулы хинализарина:

Методика:
В пробирку вносят 3-4 капли раствора соли магния, 2-3 капли спиртового раствора хинализарина и 2-3 капли раствора натрия гидроксида. Выпадает синий осадок хинализарината магния, а раствор окрашивается в васильково-синий цвет. При маленькой концентрации ионов Mg2+ осадок может и не образоваться, но окрашивание в васильковый цвет раствора будет.
Другие реакции катионов магния. Катионы Mg2+ образуют с аммония оксалатом (NH4)2C2O4 белый осадок магния оксалата MgC2O4, с дифенилкарбазидом (C6H2NHNH)2CO – комплекс красно-фиолетового цвета. Свежевыпавший осадок Mg(OH)2 при взаимодействии с гипойодидом калия KIO (или гипойодидом натрия NaIO) окрашивается в красно-бурый цвет вследствие сорбции йода на поверхности гидроксида магния.
