
3.Кинетика ферментативного катализа (продолжение).
3.3.Ингибиторы и активаторы ферментов.
Соединения, которые при добавлении их в реакционную смесь вызывают уменьшение скорости ферментативной реакции, называются ингибиторами. Один из классов ингибиторов – необратимые ингибиторы или каталитические яды. Они взаимодействуют с ферментом и снижают его активность до нуля, например, ионы тяжелых металлов.
Другим классом ингибиторов является обратимые ингибиторы. Они образуют с ферментом динамические комплексы. Эти комплексы отличаются по своим каталитическим свойствам от свободного фермента. Фермент в присутствии ингибитора может характеризоваться более высоким численным значением константы Михаэлиса Km. Такой вид ингибирования получил название конкурентное ингибирование. При реакции может наблюдаться также более низкое значение максимальной скорости υmax – это чистое неконкурентное ингибирование. При ферментативной реакции могут наблюдаться численные значения υmax и Km, уменьшенные в одинаковой степени – это бесконкурентное ингибирование, или определенная комбинация υmax и Km – это смешанное ингибирование. Понятие «чистое неконкурентное ингибирование» используется редко.
Для определения типа ингибирования используют механизм, предложенный Боттсом и Моралесом. Большинство простых типов ингибирования являются частными случаями этого механизма, представленного на схеме (Е – фермент; I – ингибитор; S – субстрат; Р – продукт реакции):
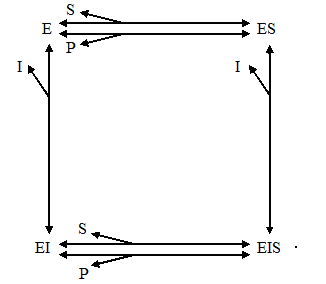
Эта схема включает четыре формы фермента (E, ES, EI и EIS) и шесть реакций, протекающих между ними. Все простые случаи можно получить, если не учитывать некоторых реакций. Например, ингибирование является конкурентным, если отсутствует форма EIS и протекающие с ее участием реакции; неконкурентным, если отсутствует форма EI, и смешанным, если в схеме присутствуют обе указанные выше формы (EIS и EI), однако прямой переход между ними невозможен. Схема Боттса – Моралеса особенно полезна при анализе ингибиторов, которые не являются продуктами ферментативной реакции.
Эта схема описывает также некоторые механизмы действия активатора, когда в систему вносят вещество, повышающее скорость реакции. Поэтому ее можно рассматривать как общую схему, описывающую механизм действия модификаторов, под которыми понимают как ингибиторы и активаторы одновременно.
3.3.1.Конкурентное ингибирование.
Самый распространенный тип ингибирования назван конкурентным ингибированием, поскольку наиболее простое объяснение данного типа ингибирования сводится к тому, что ингибитор связывается с тем же самым активным центром молекулы фермента, что и субстрат. При этом образуется непродуктивный комплекс. Субстрат и ингибитор конкурируют за один и тот же центр связывания и, следовательно, может образоваться только один комплекс фермента с ингибитором – EI. В простейшем случае конкурентного ингибирования EI представляет собой «тупиковый» комплекс, поскольку он распадается в результате диссоциации только на исходные компоненты (E + I). Поэтому концентрация комплекса EI определяется истинной константой равновесия:
Кi = [E] ∙ [I]/[EI].
Данную константу (Кi) называют константой ингибирования. Полное уравнение стационарной скорости для случая простого конкурентного ингибирования имеет следующий вид:
υmax ∙ [S]
υо = —————————,
Km ∙ (1 + [I]/Кi) + [S]
где: [I] – концентрация свободного ингибитора.
Это уравнение совпадает по форме с уравнением Михаэлиса – Ментен, то есть его можно записать в следующем виде:
υо = υmax, каж ∙ [S]/(Km, каж + [S]),
где: υmax, каж и Km, каж – «кажущиеся» значения параметров υmax и Km, которые определяются следующими выражениями:
υmax, каж = υmax; Km, каж = Km ∙ (1 + [I]/Кi).
υmax/Km
При этом: υmax, каж/Km, каж = ——————.
(1 + [I]/Кi)
Следовательно, влияние конкурентного ингибитора на скорость ферментативной реакции состоит в том, что он увеличивает кажущееся значение константы Михаэлиса Km в (1 + [I]/Кi) раз и уменьшает в то же число раз кажущееся значение υmax/Km, оставляя без изменения величину υmax.
