
ЛЕКЦИЯ №7
Строение и электрический заряд коллоидных частиц
Электрокинетические явления
Дисперсную фазу в коллоидных растворах представляют частицы со сложной структурой. Их называют – мицеллы. Лиофобные коллоидные растворы обязательно требуют присутствия специального стабилизатора-электролита. Ионы стабилизатора адсорбируются на частицах дисперсной фазы, образуя на их поверхности двойной электрический слой (ДЭС) и обеспечивают устойчивость системы. Образовавшиеся при этом микроструктуры представляют собой мицеллы.
Мицеллой лиофобной системы называется гетерогенная микросистема, которая состоит из микрокристаллика дисперсной фазы, окруженного сольватированными ионами стабилизатора.
Рассмотрим образование мицеллы коллоидного раствора иодида серебра при взаимодействии разбавленных водных растворов нитрата серебра и иодида калия, взятого в избытке, ионы которого K+ и I+ играют роль стабилизатора. Реакция протекает по уравнению:
AgNO3 + KI = AgI + KNO3
При сливании растворов в присутствии стабилизатора возникают незаметные на глаз микрокристаллики иодида серебра, каждый из которых является агрегатом, состоящим из некоторого числа m молекул AgI. Агрегат в результате избирательной адсорбции ионов I- (согласно правилу Панета-Фаянса) приобретает заряд. Ионы I-, адсорбируясь в некотором количестве n, сообщают ему отрицательный заряд. Ионы, определяющие заряд агрегата называют потенциалопределяющими. Агрегат и потенциалопределяющие ионы образуют ядро мицеллы, ее твердую фазу. Это записывают так:

К заряженной поверхности ядра вследствие электростатического притяжения притягиваются противоположно заряженные ионы стабилизатора, т.е. катионы K+, называемые противоионами. Это так называемые “связанные” или “неподвижные” противоионы.
Потенциалопределяющие ионы и “связанные” противоионы образуют адсорбционный слой. Агрегат вместе с адсорбционным слоем называют гранулой
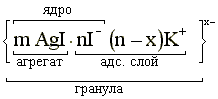
Гранула имеет заряд, знак которого определяется знаком заряда потенциалопределяющих ионов.
Оставшиеся противоионы (не вошедшие в адсорбционный слой), т.е. x катионов K+, необходимые для компенсации заряда гранулы, испытывают электростатическое притяжение со стороны гранулы и, благодаря силам диффузии, располагаются вокруг гранулы более рыхло, диффузно. Эти противоионы вместе со своими сольватными гидратными оболочками образуют диффузный слой и называются “подвижными” или “свободными” противоионами. Гранула вместе с диффузным слоем образует мицеллу.
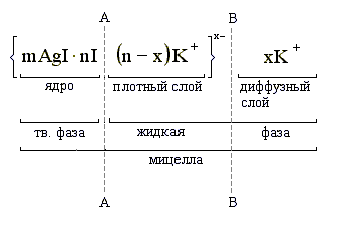
АА – межфазная граница BB – граница скольжения
Если при проведении реакции между KI и AgNO3 в избытке взят AgNO3, то строение мицеллы будет следующее:
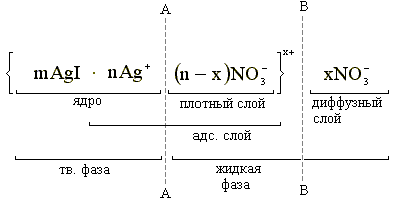
АА – межфазная граница BB – граница скольжения
Строение мицеллы золя гидроксида железа (III).
Гидроксид железа (III) образуется при гидролизе хлорного железа
FeCl3 + 3H2O → Fe(OH)3↓ + 3HCl
Продукты реакции взаимодействуют между собой
Fe(OH)3
+ HCl
![]() FeOCl + 2H2O
FeOCl + 2H2O
Образующаяся хлорокись железа является стабилизатором:
FeOCl FeO+ + Cl-
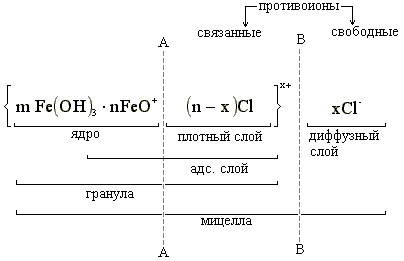
Таким образом, твердую фазу составляют агрегат и потенциалопределяющие ионы, а все противоионы (связанные и свободные) – находятся в жидкой фазе. Граница между твердой фазой и жидкой фазой называется межфазной границей (АА). Граница между гранулой и диффузным слоем называется границей скольжения (ВВ); по этой условной границе происходит перемещение в электрическом поле гранулы (дисперсной фазы) и противоионов диффузного слоя (дисперсионной среды) к противоположно заряженным электродам.
В мицелле на границе раздела фаз имеется двойной электрический слой (ДЭС), который состоит из потенциалопределяющих ионов и такого же количества противоположно заряженных ионов-противоионов.
Расположение противоионов определяется двумя факторами:
тепловое движение стремится к равномерному распределению ионов
силы электростатического притяжения стремятся удержать их вблизи поверхности раздела фаз
В результате действия этих двух тенденций устанавливается диффузионное распределение противоионов с уменьшающейся концентрацией по мере их удаления от границы раздела фаз.
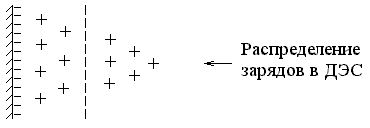
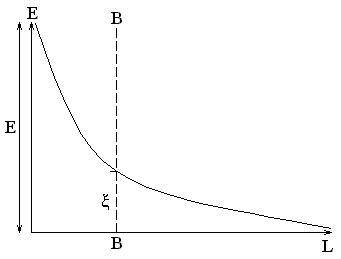
На границе раздела различают два потенциала: межфазный или электротермодинамический E и электрокинетический или ξ-потенциал (дзета-потенциал).
Межфазным потенциалом называется потенциал ДЭС на границе раздела между твердой и жидкой фазами в мицелле (на схемах – граница АА)
Электрокинетическим потенциалом (ξ-потенциалом) называется потенциал на границе скольжения между адсорбционной и диффузной частями ДЭС (на схемах – граница BB)
Величина межфазного электротермодинамического потенциала зависит:
от природы вещества, входящего в состав ядра
от заряда и концентрации потенциалопределяющих ионов
Величина электрокинетического (ξ-потенциала) зависит:
от толщины диффузного слоя: чем она меньше, тем меньше ξ-потенциал. Толщина диффузного слоя в свою очередь зависит от концентрации противоионов и их заряда. Чем выше их концентрация и больше заряд, тем больше противоионов будут находиться в адсорбционном слое и меньше в диффузном, что уменьшает ξ-потенциал.
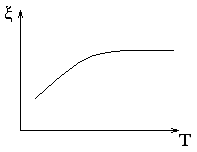
от температуры
Повышение температуры приводит к расширению диффузного слоя. Кроме того, приобретя высокую тепловую энергию, часть противоионов переходит из плотного слоя в диффузный, что приводит к увеличению ξ-потенциала.
Однако при очень высоких температурах начинается десорбция потенциалопределяющих ионов, что означает снижение электротермодинамического потенциала, а, следовательно, и его составляющей, т.е. ξ-потенциала. В результате возникает двухфазный эффект.
Электрокинетические явления
Различают 4 вида электрокинетических явлений: электрофорез, электроосмос, потенциал протекания (течения), потенциал седиментации (оседания).
Под действием внешнего электрического поля наблюдаются два явления:
перемещение частиц дисперсной фазы относительно неподвижной дисперсионной среды – электрофорез.
перемещение дисперсионной среды относительно неподвижной дисперсной фазы – электроосмос.
Явления, обратные электрофорезу и электроосмосу.
Возникновение разности потенциалов при перемещении дисперсной фазы относительно неподвижной дисперсионной среды – потенциал седиментации (оседания).
Возникновение разности потенциалов при перемещении дисперсионной среды относительно неподвижной дисперсной фазы – потенциал протекания.
Причиной электрокинетических явлений является образование двойного электрического слоя и, как следствие, наличие электрического заряда, как у частиц дисперсной фазы, так и у частиц дисперсионной среды.
Значение электрофореза, электроосмоса
Электрофорез используют в клинических исследованиях для диагностики многих заболеваний, для разделения аминокислот, нуклеиновых кислот, антибиотиков, ферментов, форменных элементов крови, для определения чистоты белковых препаратов, для введения лекарственных препаратов.
Кроме того в медицине электрофорез применяют для введения лекарственных препаратов. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху электроды, к которым приложен низкий, безопасный для организма потенциал. Частички лекарственного препарата под действием электрического поля переходят в ткани организма.
Электроосмос используют для обезвоживания различных пористых материалов. Влажную массу помещают между электродами, а вода под действием электрического поля в зависимости от структуры ДЭС перемещается к одному из электродов и собирается в специальные емкости.
Скорость электрофореза (электрофоретическую активность) рассчитывают по уравнению Гельмгольца-Смолуховского:
![]()
где
U – скорость электрофореза (электрофоретическая подвижность)
ε – диэлектрическая проницаемость среды
ξ – электрокинетический потенциал
H – напряженность электрического поля
η – вязкость среды
Напряженность электрического поля выражается отношением разности потенциалов к расстоянию между электродами:
![]()
Тогда
![]()
Устойчивость дисперсных систем
Под устойчивостью дисперсной системы понимают ее способность сохранять во времени
средний размер частиц
их равномерное распределение в среде
Для дисперсных систем различают два вида устойчивости – кинетическую (седиментационную) и агрегатную.
Кинетическая (седиментационная) устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегатная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять неизменными свои размеры.
Коллоидные растворы по устойчивости занимают промежуточное положение между грубодисперсными системами и истинными растворами. Коллоидные растворы обычно представляют собой седиментационно устойчивые системы, что обусловлено
малыми размерами частиц
их интенсивным броуновским движением
К факторам агрегативной устойчивости относится следующее:
наличие электрического заряда частиц препятствует их слипанию
способность к сольватации противоионов диффузного слоя; образующиеся на поверхности частиц защитные слои из сольватированных противоионов также препятствуют их слипанию
адсорбция на поверхности веществ ПАВ (поверхностно-активных веществ); вокруг “гидрофильных головок” ПАВ ориентируются диполи воды, в результате формируется адсорбционно-сольватный слой, препятствующий слипанию. Данное явление называется - “коллоидная защита”
вязкость среды: чем больше вязкость, тем меньше скорость частиц, меньше возможности для столкновения и седиментации.
Нарушение устойчивости дисперсных систем приводит к возникновению коагуляции, а в дальнейшем к седиментации частиц дисперсной фазы.
