
- •Учебные работы
- •Материальный баланс алюминиевого электролизера
- •Баланс напряжения электролизера
- •Тепловой баланс электролизера
- •Режим восстановления
- •Технологический контроль электролиза
- •Флюсы, применяемые при плавке алюминиевых сплавов
- •Состав универсальных флюсов
- •Результаты дилатометрических измерений
- •Результаты лабораторных измерений и расчетов реакционной активности углерода
- •Коэффициенты нормированных отклонений (для малого числа наблюдений)
- •Учебно-исследовательские работы
Результаты дилатометрических измерений
, мин |
l, мм |
l, мм |
Vд, мм/(мммин) |
С, мммин/мм |
Режим электролиза и состав образца |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Работа 7. АНОДНОЕ ОКИСЛЕНИЕ УГЛЕРОДА
Цель работы. Знакомство с теоретическими основами анодного окисления углеграфитовых изделий и количественной оценкой их реакционной активности.
Основные определения, теория и технология
Анод алюминиевых электролизеров изготавливают из анодной массы – смеси предварительно прокаленного кокса и пека (см. работы 2 и 6). Несмотря на кажущуюся однородность обожженного анода, в его структуре четко прослеживаются две составляющие: зерна кокса-наполнителя и оболочка этих зерен (кокс из связующего). Разница в реакционных способностях этих двух видов кокса приводит к неравномерному окислению электрода, так как зерна кокса-наполнителя не успевают сгореть полностью.
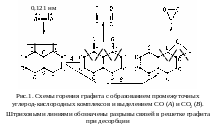
транспорт
кислородсодержащих ионов, обозначаемых
в дальнейшем как
![]() ,
т.е. ионов кислорода в оксифторидных
комплексах, из глубины расплава к
поверхности анода:
,
т.е. ионов кислорода в оксифторидных
комплексах, из глубины расплава к
поверхности анода:
![]() ,
где индекс э – относится к иону в глубине
электролита, индекс а – к поверхности
анода;
,
где индекс э – относится к иону в глубине
электролита, индекс а – к поверхности
анода;
окисление
ионов кислорода на поверхности угольного
анода с образованием промежуточных
хемосорбированных комплексов:
![]() –
2e + xC CxO;
–
2e + xC CxO;
распад промежуточных комплексов (десорбция хемосорбированного кислорода в виде CO2) по реакции 2CxO CO2 + (2x – 1)C.
Если первичным газом, выделяющимся на аноде по реакции
Al2O3 + 1,5 C = Al + 1,5 CO2,
является CO2, то теоретический расход углерода на 1 кг алюминия составит 0,333 кг. При первичном выделении CO он вырастет в 2 раза, до 0,666 кг/кг. Так как часть анода теряется из-за его перехода в угольную пену, а масса анодных огарков в электролизерах ОА достигает 20 %, то угольные аноды с полным правом можно отнести к высоко расходуемым материалам. Для электролизеров различных типов расход углерода составляет от 500 до 600 кг на 1 т алюминия.
Причины появления CO в анодных газах две: взаимодействие первичного CO2 с растворенным в электролите алюминием по реакции
2Al + 3CO2 = Al2O3 + 3CO
и реакция окисления неполяризованного, т.е. не покрытого комплексами CxO углерода (реакция Будуара)
C + CO2 = 2CO.
Содержание CO в анодных газах, а значит, и количество углерода, расходуемого на разложение Al2O3, зависит от параметров электролиза. Поэтому суммарная реакция электролиза имеет вид
Al2O3 + yC = 2Al + (3 – y)CO2 + (2y – 3)CO,
где y – переменное количество молей углерода.
Тогда расход углерода в суммарной реакции, выраженный через состав анодных газов:
![]() ,
,
где
mC – заданный расход углерода
на 1 кг алюминия, кг;
![]() – доля CO2 в анодном газе.
– доля CO2 в анодном газе.
Перерасход углерода по отношению к стехиометрии обусловлен в основном осыпанием частиц анода в электролит с образованием угольной «пены». Этот процесс связан с различной структурой двух видов кокса, из которых состоит анод. Чем больше разнится химическая активность этих двух составляющих, тем больше образуется «пены» и выше расход углерода.
Наиболее общей характеристикой качества анода является его реакционная способность, т.е. количество выгоревшего углерода с единицы площади электрода в единицу времени, причем под выгоревшим подразумевается не только окислившийся, но и осыпавшийся углерод.

Основные пути сближения реакционной активности двух составляющих анода – это применение в качестве связующего пеков с повышенной температурой размягчения, подбор рационального гранулометрического состава кокса-наполнителя и введение в связующее ингибиторов окисления углерода (B2O3, AlF3).
Другой путь снижения расхода углерода связан с оптимизацией режима электролиза. В первом приближении между высотой выступов на аноде и плотностью тока соблюдается зависимость
h = /(iа),
где h – средняя высота выступов; – разность перенапряжений между выступами и впадинами; – удельное сопротивление электролита; iа – анодная плотность тока.
Приняв, что перерасход анода на осыпание в виде «пены» прямо пропорционален высоте выступов, получим связь между расходом анода qC и плотностью тока (рис.3)
qC = a + b/iа,

Добавки в электролит хлоридов (NaCl, MgCl2 и др.) приводят не только к заметному снижению расхода углерода в процессе электрохимического окисления, но и к уменьшению выгорания боковых граней анода, смоченных электролитом, что связывается с избирательной адсорбцией Cl– на активных центрах поверхности анода, приводящей к торможению ионов кислорода.

Содержание задания. Сведения по составу исследуемых образцов и газовой атмосферы, температуре и продолжительности опыта.
Порядок работы
1. Разогреть печь термовесовой установки до заданной температуры, обеспечив в дальнейшем изотермический режим опыта.
2. Измерить геометрические размеры образца углеграфитового материала и рассчитать его кажущуюся поверхность. Образец просушить при температуре около 200 С, затем установить в термовесовую установку и выполнить измерения массы образца через заданные промежутки времени. Результаты измерений записать в таблицу.
