
- •Учебные работы
- •Материальный баланс алюминиевого электролизера
- •Баланс напряжения электролизера
- •Тепловой баланс электролизера
- •Режим восстановления
- •Технологический контроль электролиза
- •Флюсы, применяемые при плавке алюминиевых сплавов
- •Состав универсальных флюсов
- •Результаты дилатометрических измерений
- •Результаты лабораторных измерений и расчетов реакционной активности углерода
- •Коэффициенты нормированных отклонений (для малого числа наблюдений)
- •Учебно-исследовательские работы
Баланс напряжения электролизера
Составляющие среднего напряжения |
Расчетное уравнение |
Расчетное значение, В |
Доля в среднем напряжении, % |
|
Падение напряжения в аноде Ua |
(5) |
|
|
|
Падение напряжения в электролите Uэл |
(6) |
|
|
|
Падение напряжения в подине Uпод |
(7) |
|
|
|
Напряжение разложения Е |
(8) |
|
|
|
|
|
|
|
|
Итого греющее напряжение Uгр |
|
|
|
|
Дополнительное падение напряжения в шинах, контактах и т.д. Uдоп |
|
|
1418 |
|
|
|
|
|
|
Итого среднее напряжение Uср |
(4) |
|
|
|
Тепловой баланс электролизера составляют с использованием данных материального и электрического балансов на 1 ч работы. Для известной конструкции уравнение теплового баланса можно представить в виде
Qэл + Qан = Qразл + Qмет + Qгаз + Qп,
где Qэл и Qан – приход тепла от электрической энергии и от сгорания угольного анода соответственно; Qразл – тепло, необходимое на разложение глинозема; Qмет и Qгаз – тепло, уносимое вылитым металлом и отходящими газами соответственно; Qп – потери тепла в окружающее пространство конструктивными элементами электролизера.
Расчет ведется в килоджоулях по форме табл.3.
Приход тепла от прохождения электрического тока
![]() ,
(9)
,
(9)
где
![]() – греющее напряжение по данным табл.2, В.
– греющее напряжение по данным табл.2, В.
Таблица 3
Тепловой баланс электролизера
Составляющие баланса |
Расчетное уравнение |
Приход |
Составляющие баланса |
Расчетное уравнение |
Приход |
|||
кДж |
% |
кДж |
% |
|||||
Qэл |
(9) |
|
|
Qразл |
(11) |
|
|
|
Qан |
(10) |
|
|
Qмет |
(12) |
|
|
|
|
|
|
|
Qгаз |
(13) |
|
|
|
|
|
|
|
Qп |
|
|
|
|
|
|
|
|
|
|
|
|
|
Итого |
|
|
100 |
|
|
|
100 |
|
Приход тепла от сгорания угольных анодов
![]() ,
(10)
,
(10)
где
![]() и
и
![]() – соответственно число киломолей СО2
и СО, выделяющихся за 1 ч;
– соответственно число киломолей СО2
и СО, выделяющихся за 1 ч;
![]() и
и
![]() – тепловые эффекты реакций полного и
неполного горения углерода при температуре
поверхности анода.
– тепловые эффекты реакций полного и
неполного горения углерода при температуре
поверхности анода.
Число киломолей продуктов горения можно определить из материального баланса (см. табл.1):
![]() и
и
![]() ,
,
где
![]() и
и
![]() – массовая концентрация СО2
и СО в газе соответственно; 44 и 28 –
молекулярная масса СО2
и СО соответственно, кмоль/кг.
– массовая концентрация СО2
и СО в газе соответственно; 44 и 28 –
молекулярная масса СО2
и СО соответственно, кмоль/кг.
Тепловые эффекты реакций горения с образованием СО2 и СО в первом приближении соответственно
![]() кДж/моль;
кДж/моль;
![]() кДж/моль,
кДж/моль,
где T – температура поверхности анода, К.
Расход тепла на разложение глинозема
![]() ,
(11)
,
(11)
где
1,89Р
– теоретический расход глинозема, кг/ч;
![]() – тепловой эффект реакции окисления
алюминия, при температуре электролиза
с учетом теплоты плавления алюминия
– тепловой эффект реакции окисления
алюминия, при температуре электролиза
с учетом теплоты плавления алюминия
=1725722 – 61,71(Т – 298) + 31,82(Т – 932) кДж/моль,
где T – температура электролита, К.
Потери тепла с выливаемым из ванны алюминием рассчитываются, исходя из условия, что количество вылитого алюминия соответствует количеству наработанного в то же время металла. При температуре выливаемого алюминия 960 С энтальпия алюминия составляет 43982 кДж/кмоль, а при 25 С – 6717 кДж/кмоль. Тогда потери тепла с выливаемым алюминием
![]() кДж.
(12)
кДж.
(12)
Унос тепла с газами рассчитываем, принимая, что разбавление газов за счет подсоса воздуха в систему отсутствует. Температура отходящих газов, по данным практики 550 С. Потери тепла с газами
![]()
![]() кДж,
(13)
кДж,
(13)
где 40488 и 16446 – рассчитанные по справочным данным энтальпии диоксида углерода соответственно при 550 и 25 С, кДж/кмоль; 24860 и 8816 – то же для оксида углерода, кДж/кмоль.
Тепловые потери с поверхности электролизера Qп, связанные с конвективным теплообменом и излучением, наиболее трудоемки для определения. Эти расчеты осложняются также различием в условиях теплопередачи для отдельных поверхностей и тепловых зон электролизера. Считая модельный электролизер сбалансированным, тепловые потери можно определить по разности статей прихода и расхода в тепловом балансе.
Лабораторное оборудование. Модель алюминиевого электролизера, изготовленная в масштабе 1:20 в отделе макетного проектирования института ВАМИ.
Содержание задания. Данные по анодной плотности тока, выход по току алюминия, состав анодных газов, температура электролита и другие сведения технологического характера.
Порядок работы
1. Ознакомиться на макете электролизера с конструкцией алюминиевого электролизера типа ОА. Дать краткое описание отличительных особенностей этой конструкции, ее достоинств и недостатков.
2. Выполнить необходимые геометрические измерения и с учетом масштаба модели произвести балансовый расчет реального промышленного электролизера указанного типа, сводя результаты расчетов в табл.1-3.
3. Дать анализ полученных результатов в соответствии с заводской практикой эксплуатации алюминиевых электролизеров.
Работа 3. ПОЛУЧЕНИЕ МАГНИЯ МЕТАЛЛОТЕРМИЧЕСКИМ СПОСОБОМ
Цель работы. Знакомство с теорией и практикой металлотермического производства магния.
Основные определения, теория и технология
Способы получения металлов, в которых восстановитель также металл, называются металлотермическими. Они широко применяются в металлургии легких и редких металлов. В общем виде реакция металлотермического восстановления выражается уравнением
Me'nAm + nMe" = nMe' + Me"nAm,
где Me' и Me" – соответственно металлы, выполняющие роль окислителя и восстановителя (в данном случае с равной валентностью); A – анион (кислород, хлор и др.).
Восстановителями магния из его оксида служат такие элементы, которые образуют с кислородом термодинамически более прочные соединения, чем МgО. Мерой химической прочности оксида является энергия Гиббса для образования оксида из элементов – сродство к кислороду. Чем более положительное значение имеет энергия Гиббса, тем менее устойчив оксид, тем легче из него может быть восстановлен металл другим элементом, оксид которого характеризуется более отрицательным значением энергии Гиббса его образования.
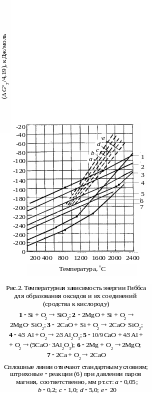
На рис.1
приведены температурные зависимости
стандартных значений энергии Гиббса
![]() образования оксидов из элементов (в
расчете на 1 моль кислорода), откуда
видно, что наибольшим сродством к
кислороду обладает кальций. Следовательно,
он способен восстанавливать из оксидов
все металлы, характеризующиеся меньшей
абсолютной величиной
при данной температуре. Точки пересечения
графиков
= f(Т)
для двух оксидов указывают температуру,
при которой восстановление, т.е. замена
магния в оксиде другим элементом,
становится термодинамически равновероятной.
Из такой очень приближенной оценки
следует, что восстановление магния
алюминием начинается при 1500 С,
а кремнием лишь выше 2300 С.
Но реакция может быть осуществлена при
более низких температурах, если,
во-первых, путем вакуумирования понижать
давление паров магния над реакционной
смесью, во-вторых, связать оксид
восстановителя в иное, термодинамически
более устойчивое соединение, например,
SiO2 – в двухкальциевый силикат
2CaOSiO2,
Al2O3
– в алюминат
кальция 5CaO3Al2O3
и т.д. Количественная оценка влияния
давления на установление равновесия
возможна с помощью уравнения изотермы
химической реакции (изотермы Вант-Гоффа).
образования оксидов из элементов (в
расчете на 1 моль кислорода), откуда
видно, что наибольшим сродством к
кислороду обладает кальций. Следовательно,
он способен восстанавливать из оксидов
все металлы, характеризующиеся меньшей
абсолютной величиной
при данной температуре. Точки пересечения
графиков
= f(Т)
для двух оксидов указывают температуру,
при которой восстановление, т.е. замена
магния в оксиде другим элементом,
становится термодинамически равновероятной.
Из такой очень приближенной оценки
следует, что восстановление магния
алюминием начинается при 1500 С,
а кремнием лишь выше 2300 С.
Но реакция может быть осуществлена при
более низких температурах, если,
во-первых, путем вакуумирования понижать
давление паров магния над реакционной
смесью, во-вторых, связать оксид
восстановителя в иное, термодинамически
более устойчивое соединение, например,
SiO2 – в двухкальциевый силикат
2CaOSiO2,
Al2O3
– в алюминат
кальция 5CaO3Al2O3
и т.д. Количественная оценка влияния
давления на установление равновесия
возможна с помощью уравнения изотермы
химической реакции (изотермы Вант-Гоффа).
2MgO + Si = 2Mgгаз + SiO2
уравнение изотермы приобретает вид:
![]()
![]() ,
(1)
,
(1)
где
![]() и
и
![]() – неравновесное и равновесное давления
магния при данной температуре.
– неравновесное и равновесное давления
магния при данной температуре.
С кинетической
точки зрения, развитие реакции, протекающей
с выделением газообразных продуктов,
обусловлено скоростью их удаления.
Достаточная для практики скорость
реакции достигается тогда, когда
равновесное парциальное давление паров
магния станет хотя бы равным давлению
остаточных, не участвующих в реакции
газов. Для исключения лимитирующей роли
диффузии паров и достижения возможно
более высокой скорости процесса за счет
повышения температуры
необходимо соблюдение условия
![]()
![]() .
.
Конденсация паров магния наступает при их давлении, превышающем упругость насыщенного пара магния в конденсаторе. Возможность конденсации магния в твердом или жидком состоянии зависит от температуры и давления в конденсаторе. Если давление не превысит величины, отвечающей тройной точке (2,63 мм рт.ст. при t = 651 С), то магний будет конденсироваться только в твердом состоянии.
Термическая технология магния – это радикальная альтернатива электролитическому методу, который достаточно сложен и потому рентабелен лишь при организации крупномасштабного производства (мощностью около 30000 т/год). К недостаткам электролитического способа следует отнести трудно решаемые проблемы коррозионной стойкости аппаратуры и загрязнения окружающей среды. Следует сказать, что термические способы в значительной степени свободны от этих недостатков.
Вакуумное восстановление обожженного доломита кремнием (с использованием ферросилиция, содержащего более 75 % Si) требует меньших капитальных затрат, чем электролитический метод. Кроме того, вакуумное восстановление легче приспособить к требованиям конъюнктуры, оборудование быстрее выходит на проектную мощность. Эта технология не требует длительного обучения персонала и, наконец, является менее опасной для окружающей среды.

2(СаО + MgO) + Si = 2CaOSiO2 + 2Mg. (2)
Однако при температуре реального процесса (1300 С) реакция идет ступенчато, через стадию образования летучего монооксида кремния:
MgO + Si = Mg(г) + SiO(г);
3CaO + SiO(г) = Ca(г) + 2CaOSiO2;
Сa(г) + MgO = Mg(г) + СаО.
Замена ферросилиция на алюмокремниевые сплавы позволяет более полно использовать их восстановительную способность, связанную с участием в реакциях алюминия:
2(CaO + MgO) +![]() Al = 2Mg +
Al = 2Mg +![]() (5CaO3Al2O3) +
(5CaO3Al2O3) +![]() CaO.
(3)
CaO.
(3)
Лабораторное оборудование Весы, гидравлический пресс и специализированная высокотемпературная установка, обеспечивающая возможность физического моделирования основных технологических процессов и операций для металлотермического получения магния, включая шихтовку, брикетирование и вакуумное восстановление.
Содержание задания. Требования к составу и количеству шихты, режиму шихтоподготовки и металлотермического восстановления.
Порядок работы
1. Рассчитать шихту для металлотермического восстановления доломита по реакциям (2) и (3) с учетом заданного избытка восстановителя от его стехиометрического количества, состава используемого сырья и количества вводимого минерализатора (флюорита).
2. Брикетированную шихту после взвешивания загрузить в реторту. Взвесить разъемную часть реторты для конденсации паров магния. Реторту собрать и установить в трубчатую печь. Ознакомиться с устройством термоустановки и методами контроля технологического режима. Зарисовать схему установки.
3. Включить вакуум-насос и при достижении величины остаточного давления в системе (0,1 мм рт.ст.) начать разогрев трубчатой печи до заданной температуры (1050-1200 С) со скоростью около 20 С/мин. Регулировка скорости обеспечивается изменением электрической нагрузки подаваемой на печь от автотрансформатора в пределах 0-180 В. Каждые 10 мин вести запись режимных показателей процесса (см. таблицу). По достижении максимальной температуры процесса произвести изотермическую выдержку в течение 40-60 мин.
