
- •Методичні рекомендації
- •Лабораторна робота №16
- •Міри безпеки:
- •1.1.3. Дослідження явища фотоефекту
- •1.1.4. Дослідження спектрів випромінювання атомів
- •1.2. Дослідження структури атома
- •1.2.1. Будова атома за е.Резерфордом.
- •1.2.2 Будова атома за н.Бором
- •1.2.3 Квантова теорія атомів
- •2. Призначення, будова та принцип дії установки для дослджіення спектрів атомів фпк-09.
- •2.1 Призначення установки фпк-09
- •2.2 Будова установки фпк-09
- •2.3 Принцип дії установки фпк-09
- •3.2 Завдання
- •3.2.1 Виконання експериментальних досліджень
- •3.2.2 Виконання розрахунків та побудова спектрів
- •3.2.3 Аналіз результатів досліджень та висновки
- •4. Контрольні запитання та завдання
- •4.1 Контрольні запитання
- •Література
1.2.3 Квантова теорія атомів
В квантовій механіці опис стану мікрооб’єкта здійснюється має статистично, має ймовірнісний характер.
Ймовірність
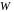 знаходження частинки в момент часу
знаходження частинки в момент часу
 в об’ємі з координатами
в об’ємі з координатами
 ,
,
 ,
,
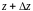 визначається квадратом модуля хвильової
функції
визначається квадратом модуля хвильової
функції
 (квадрат модуля амплітуди хвилі де
Бройля).
(квадрат модуля амплітуди хвилі де
Бройля).
(або
в сферичних координатах
|
|
Ймовірність
знаходження частинки в об’ємі

|
|
Значення
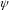 ‑ функції знаходиться з стаціонарного
рівняння Шредінгера
‑ функції знаходиться з стаціонарного
рівняння Шредінгера
|
(11) |
де ‑ повна енергія електрона в атомі.
 ‑ оператор Лапласа в
сферичних координатах
‑ оператор Лапласа в
сферичних координатах
 .
.
Розв’язок рівняння Шредінгера (11), відносно енергії атома , має вигляд:
|
(12) |
де
|
(13) |
Квантування енергії випливає з самого розвязку.
Порівняння формули (12), (13) з відповідними формулами (6), (8) теорії Бора показує, що вони повністю співпадають.
Але квантова теорія більш глибока.
Дійсно,
розв’язок рівняння Шредінгера, приводить
до квантування не тільки енергії, а і
трьох координат
,
 ,
,
 ,
що визначається трьома квантовими
числами: головним квантовим числом
,
орбітальним
і магнітним
,
що визначається трьома квантовими
числами: головним квантовим числом
,
орбітальним
і магнітним
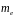 .
Так як електрон має власний механічний
момент імпульсу (спін), який також
кантується, то вводять і спінове квантове
число
.
Так як електрон має власний механічний
момент імпульсу (спін), який також
кантується, то вводять і спінове квантове
число
 .
.
Головне
квантове число
‑ виражає енергетичні рівні електрона
в атомі і може набувати значень

Орбітальне
квантове число
 визначає величину модуля вектора моменту
імпульсу електрона в атомі при заданому
.
визначає величину модуля вектора моменту
імпульсу електрона в атомі при заданому
.
|
|
де
 .
.
Магнітне
квантове число
визначає проекцію моменту імпульсу
електрона на заданий напрямок (визначає
положення вектора моменту імпульсу
 електрона.
електрона.
|
|

Спінове
квантове число
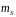 визначає положення спіну електрона в
атомі і може приймати тільки два значення
визначає положення спіну електрона в
атомі і може приймати тільки два значення
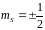 .
.
Узагальнюючи експериментальні і теоретичні дані Паулі сформулював принцип (принцип Паулі) який завжди реалізується в мікроскопічних системах. В системі однакових ферміонів довільні два з них не можуть одночасно знаходитися в одному і тому ж стані, тобто не можуть мати однаковими всі чотири квантові числа.
Ферміони – частинки з пів цілим спіном (електрон, протон, нейтрон).
Сукупність
електронів, що мають однакові значення
квантового числа
,
утворює оболонку. Оболонка поділяється
на
під оболонок, які відрізняються значеннями
орбітального квантового числа
.
Число під оболонок дорівнює
,
оскільки орбітальне квантове число
набуває значень від 0 до
 .
.
Кількість
електронів в підоболонці визначається
магнітним
і спіновим
квантовими числами: максимальне число
електронів в підоболонці з даним
дорівнює
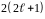 .
.
Таким чином максимальна кількість електронів в оболонці може бути:
|
(14) |
Розподіл електронів в оболонках і підоболонках приведемо на мал.

Мал.1 – Розподіл електронів в оболонках атомів
Для запису, оболонки позначають великими літерами
№ |
1 |
2 |
3 |
4 |
5 |
6 |
позначення оболонки |
K |
L |
M |
N |
O |
P |
а під оболонки малими літерами
№ |
0 |
1 |
2 |
3 |
4 |
позначення оболонки |
s |
p |
d |
f |
q |
Згідно квантової теорії атома, квантові числа і принцип Паулі визначають положення електронів в атомах, їх енергетичні рівні, а значить їх спектри випромінювання і поглинання, хімічні властивості та структуру періодичної таблиці атомів
Експеримент повністю підтверджує теоретичні передбачення квантової теорії атомів.

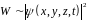 ,
, )
) ,
,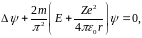
 ,
,

 ‑ стала Рідберга
‑ стала Рідберга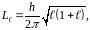
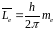 ,
, ,
,