
- •Методичні рекомендації
- •Лабораторна робота №16
- •Міри безпеки:
- •1.1.3. Дослідження явища фотоефекту
- •1.1.4. Дослідження спектрів випромінювання атомів
- •1.2. Дослідження структури атома
- •1.2.1. Будова атома за е.Резерфордом.
- •1.2.2 Будова атома за н.Бором
- •1.2.3 Квантова теорія атомів
- •2. Призначення, будова та принцип дії установки для дослджіення спектрів атомів фпк-09.
- •2.1 Призначення установки фпк-09
- •2.2 Будова установки фпк-09
- •2.3 Принцип дії установки фпк-09
- •3.2 Завдання
- •3.2.1 Виконання експериментальних досліджень
- •3.2.2 Виконання розрахунків та побудова спектрів
- •3.2.3 Аналіз результатів досліджень та висновки
- •4. Контрольні запитання та завдання
- •4.1 Контрольні запитання
- •Література
1.2. Дослідження структури атома
1.2.1. Будова атома за е.Резерфордом.
В
1913 році, для визначення розподілу заряду
в атомі, Резерфорд досліджував проходження
позитивно заряджених
 -частинок
через тонку золоту фольгу товщиною
-частинок
через тонку золоту фольгу товщиною
 ,
що складається з кількох атомарних
шарів. Він з’ясував, що
-частинки,
пройшовши через фольгу, майже не
відхиляються від прямолінійного напряму
і лише деякі частинки змінюють напрям
руху, відхиляються на дуже великі кути,
порядку
,
що складається з кількох атомарних
шарів. Він з’ясував, що
-частинки,
пройшовши через фольгу, майже не
відхиляються від прямолінійного напряму
і лише деякі частинки змінюють напрям
руху, відхиляються на дуже великі кути,
порядку
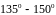 .
.
На підставі цих результатів Резерфорд зробив висновок, що атом для -частинок прозорий, а його частина, на якій відбувається розсіювання – позитивно заряджена і займає об’єм значно менший за об’єм атома.
Резерфорд,
на основі своїх досліджень, розрахував
радіус розсіюючої частинки атома:
 .
В той же час радіус атома
.
В той же час радіус атома
 .
.
Виходячи з цих розрахунків Резерфорд запропонував ядерну модель атома: в центрі атома знаходиться мале ( ) позитивно заряджене масивне ядро, на відстані , обертаються негативно заряджені електрони.
Застосування класичної електронної теорії до ядерної моделі атома привело до суперечності з експериментальними фактами.
Згідно з класичною електродинамікою «в атомі Резерфорда» повинне спостерігатись наступне:
‑ обертання заряджених електронів навколо ядра є прискорений рух, що повинно супроводжуватись постійним випромінюванням електромагнітних хвиль, втратою енергії електронами і нестабільність атомів;
‑ атоми на протязі свого існування завжди повинні випромінювати енергію;
‑ спектри випромінювання повинні бути лише неперервними;
‑ спектри випромінювання всіх атомів повинні бути подібними.
Насправді ж, як приведено вище, експеримент показує, що:
‑ атом є стійкою системою;
‑ атом випромінює енергію лише за певних умов;
‑
атом випромінює і поглинає
енергію квантами ;
;
‑ випромінювання атома має лінійчастий спектр;
Спектри випромінювання атомів різних речовин різні, і утворюються у відповідності з узагальненою формулою Бальмера та комбінаційним принципом Рітца.
Пояснити такі розбіжності класична фізика не змогла.
1.2.2 Будова атома за н.Бором
Невідповідність передбачень класичної фізики і результатів експерименту однозначно показували, що в мікроструктурі атома закони класичної електродинаміки не справджуються і що для зясування внутрішнього механізму атома слід керуватися ідею квантово теорії випромінювання Планка. Саме такі висновки зробив Н.Бор в 1913р.
В основу своєї теорії Бор поклав три постулати:
Перший
постулат Бора: (постулат
стаціонарних станів): існують деякі
стаціонарні стани атома з відповідними
значеннями енергії
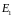 ,
,
 ,
…,
,
…, ,
перебуваючи в яких, він не випромінює
енергії.
,
перебуваючи в яких, він не випромінює
енергії.
Електрон, рухаючись по орбіті навколо ядра прискорено не випромінює енергії, що суперечить законам електродинаміки.
Другий постулат Бора (правило квантування орбіт): в стаціонарному стані атома електрон, рухаючись по коловій орбіті повинен мати квантові значення моменту імпульсу, які задовольняють умову
|
(2) |
де
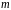 ‑ маса електрона,
‑ маса електрона,
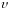 ‑ його швидкість,
‑ його швидкість,
 ‑ радіус орбіти електрона.
‑ радіус орбіти електрона.
Третій
постулат Бора (правило
частот): при переході атома з одного
стаціонарного стану в інший випромінюється
або поглинається один фотон з енергією
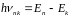 ,
яка дорівнює різниці енергій відповідних
стаціонарних станів.
,
яка дорівнює різниці енергій відповідних
стаціонарних станів.
Випромінювання
фотона відбувається при переході атома
зі стану з більшою енергією
у стан з меншою енергією
 ,
тобто при переході електрона з орбіти
більш віддаленої від ядра на ближчу
орбіту. При поглинанні енергії електрон
переходить на віддаленішу орбіту. Набір
можливих частот
,
тобто при переході електрона з орбіти
більш віддаленої від ядра на ближчу
орбіту. При поглинанні енергії електрон
переходить на віддаленішу орбіту. Набір
можливих частот
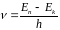 квантових переходів і визначає лінійчастий
спектр випромінювання атома.
квантових переходів і визначає лінійчастий
спектр випромінювання атома.
Постулати Бора дозволили розрахувати спектр атома водню і воднеподібних систем, а також розрахувати сталу Рідберга.
Радіус стаціонарних орбіт електрона в атомі
В атомі від’ємно заряджений електрон притягається позитивно зарядженим ядром з силою Кулона
|
|
де
 ‑ заряд ядра,
‑ заряд ядра,
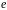 ‑ заряд електрона,
‑ заряд електрона,
 ‑ відстань електрона від ядра.
‑ відстань електрона від ядра.
Під дією цієї сили електрон має доцентрове прискорення
|
|
‑ маса електрона, ‑ орбітальна швидкість електрона.
Звідси отримується
|
|
Підставивши сюди величину , знайдену з другого постулату Бора
|
|
|
(5) |
де
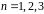
Радіуси орбіт зростають пропорційно квадратам цілих чисел.
Для
атома водню ( )
радіус першої орбіти електрона при
)
радіус першої орбіти електрона при
 називається першим борівським радіусом
(
називається першим борівським радіусом
( )
і дорівнює
)
і дорівнює
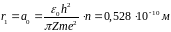 ,
,
що близька до реальних розмірів атома водню.
Енергія електрона в атомі
Енергія електрона у воднеподібній системі рівна сумі його кінетичної і потенціальної енергій в електричному полі ядра.
|
|
Враховуючи, що
|
|
Отримуємо
|
|
Тоді
 .
.
Підставивши значення маємо:
|
(6) |
Знак « ‑ » означає, що електрон знаходиться у зв’язаному стані.
Енергетичні стани атома утворюють послідовність енергетичних рівнів, що змінюються від значення , яке виражає номер енергетичного рівня атома.
При , атом водню має мінімальне енергію
 ,
а при
,
а при
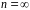 ,
,
 .
.
Тобто
енергія іонізації атома водню (енергія
необхідна для відриву електрона з першої
орбіти)
 ,
що співпадає з експериментальним
значенням.
,
що співпадає з експериментальним
значенням.
Спектри випромінювання атомів водню
Згідно третього постулату, енергія випромінювання фотона
|
|
Звідки частота випромінювання
|
(7) |
де
|
(8) |
Враховуючи, що
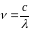 , де
‑ швидкість світла,
, де
‑ швидкість світла,
 ‑ довжина хвилі, маємо:
‑ довжина хвилі, маємо:
|
|
або |
(9) |
|
(10) |
Отримані значення співпадають з експериментальним (1).
Обмеженість теорії Бора
Розрахунки
розмірів атомів водню (5), їх енергії
іонізації, спектрів випромінювання
(7), (9), значень сталих Рідберга
 (8) і
(8) і
 (10) дають результати дуже близькі до їх
експериментальних значень, що вказує
на повну дієздатність теорії Бора.
(10) дають результати дуже близькі до їх
експериментальних значень, що вказує
на повну дієздатність теорії Бора.
Наряду з цим теорія Бора має ряд недоліків та обмежень:
‑ має внутрішні протиріччя (з одного боку, застосовує закои клаичної фізики, з іншого – ґрунтується на квантових постулатах);
‑ не може розрахувати інтенсивність спектральних ліній атома водню;
‑ не може пояснити спектри складних атомів.

 ,
,
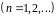 ,
,

 ,
, ,
,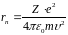 ,
,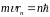 ,
отримуємо
,
отримуємо ,
або
,
або
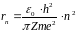
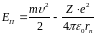 ,
, ,
, ,
,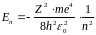 ,
, ,
,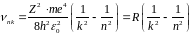 ,
, ‑ стала Рідберга
‑ стала Рідберга ,
, ‑ стала
Рідберга
‑ стала
Рідберга