
- •4 000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000Краткий курс лекций
- •4.1 Раздел: Основные понятия и законы химии
- •Типы химических реакций
- •Задания для контроля усвоения темы
- •Задания с профессиональной направленностью
- •4.2 Раздел: “Растворы. Энергетика растворения и свойства растворов”
- •Агрегатное состояние вещества
- •Массовая доля растворенного вещества в растворе ω – число единиц массы (г,кг) растворенного вещества, содержащихся в 100 единицах массы (г,кг) раствора.
- •Задания для контроля усвоения темы
- •Задания с профессиональной направленностью
- •Уравнения ионных реакций
- •Памятка по составлению ионных уравнений
- •Задания для контроля усвоения темы
- •Гидролиз
- •Задания для контроля усвоения темы
- •Значение явления гидролиза солей
- •Задания для контроля усвоения темы
- •Задания с профессиональной направленностью
- •Способы получения коллоидных растворов
- •Структура коллоидных систем
- •Свойства коллоидных систем
- •Задания для контроля усвоения темы
- •4.3 Раздел: Химическая кинетика. Химическое равновесие
- •П р и м е р 2. Реакция в гетерогенной системе
- •О т в е т. При повышении температуры с 20о до 40о скорость реакции возрастет в 9 раз. Зависимость скорости реакции от температуры точнее может быть выражена уравнением Аррениуса
- •П р и м е р 1. Константа скорости некоторой реакции при 20о равна 2 · 10-2, а при 40о 3,6 · 10-1. Вычислить энергию активации.
- •П р и м е р 3. Вычислить равновесные концентрации [h2] и [i2] в реакции
- •Задания для контроля усвоения темы
- •4.4 Раздел: Окислительно-восстановительные процессы
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса:
- •Составление окислительно-восстановительных реакций ионно-электронным методом (методом полуреакций).
- •Электрохимические и коррозионные свойства металлов
- •Устройство медно-цинкового гальванического элемента (элемента Якоби-Даниэля)
- •Электролиз
- •Примеры написания уравнений реакций электролиза.
- •Задачи для контроля усвоения темы.
- •Задания для контроля усвоения заданной темы.
- •Задания с профессиональной направленностью.
- •4.5 Раздел: Строение атомов и структура периодической системы химических элементов д.И.Менделеева
- •Строение и важнейшие свойства атомных ядер
- •Энергия связи ядер. Дефект массы
- •*Латаноиды ( электроотрицательность 1.0 - 1.2 )
- •**Актиноиды ( электроотрицательность 1.0 - 1.2 )
- •Понятие о квантовой механике
- •Квантование энергии электрона в атоме
- •Соотношение неопределенностей Гейзенберга
- •Уравнение Шрёдингера
- •Квантовые числа
- •Энергетические уровни и подуровни
- •Электронная плотность
- •Принцип минимума энергии
- •Принцип Паули
- •Правило Гунда
- •Электронные конфигурации атомов
- •Магнитные характеристики атома
- •Энергия ионизации
- •Сродство к электрону
- •Электроотрицательность
- •Химическая связь и пространственное строение молекул
- •Ионная связь
- •Ионные радиусы
- •Энергия ионной связи
- •Валентные углы
- •Энергия ковалентной связи
- •Полярность ковалентной связи
- •Металлическая связь
- •Метод валентных связей
- •Перекрывание атомных орбиталей
- •Механизмы образования ковалентных связей
- •Гибридизация атомных орбиталей
- •Дипольные моменты молекул
- •Метод молекулярных орбиталей
- •Двухцентровые молекулярные орбитали
- •Многоцентровые молекулярные орбитали
- •Межмолекулярное взаимодействие
- •Ориентационное взаимодействие
- •Индукционное взаимодействие
- •Дисперсионное взаимодействие
- •Межмолекулярное отталкивание
- •Водородная связь
- •Межмолекулярная и внутримолекулярная водородная связь
- •Межмолекулярная и внутримолекулярная водородная связь
- •Аномалии свойств, обусловленные наличием водородной связи
- •4.6 Раздел: “Комплексные соединения”
- •Номенклатура комплексных соединений
- •Задания для контроля усвоения темы
- •Задания с профессиональной направленностью
- •4.7 Раздел: Общая характеристика металлов. Сплавы
- •Химические свойства металлов
- •Задания для контроля усвоения темы
- •4.8 Раздел: Металлы 1а, 2а и 3а п∕ групп
- •Задания для контроля усвоения темы
- •Задания с профессиональной направленностью
- •4.9 Раздел: Главные переходные металлы
- •Задания для контроля усвоения темы
- •Задания с профессиональной направленностью
- •4.10 Раздел: основы химического анализа
- •Задания для контроля усвоения темы.
- •4.11 Раздел: органические вещества и их особенности
- •Классификация органических соединений
- •Классификация органических реакций по составу исходных веществ и продуктов реакции
- •Классификация
- •Овцы в синтетических шубах
- •Нумерованные животные
- •Микроб - кормилец
- •Синтетическая травка
- •Пластмассовые ракеты
- •Пластмассовый шлюз
- •Сварка без нагрева
- •Задания для контроля усвоения темы
- •Задания с профессиональной направленностью
- •Литература
- •Основная литература:
- •Дополнительная литература.
4 000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000Краткий курс лекций
4.1 Раздел: Основные понятия и законы химии
Цель: изучить важнейшие понятия химии: моль, молярная масса, эквивалент и молярная масса эквивалента, понять суть основных стехиометрических законов и научится делать расчёты на основе полученных теоретических знаний.
Исторические аспекты развития химии
Химия — очень древняя наука. Существует несколько объяснений слова «химия». Согласно одной из имеющихся теорий, оно происходит от древнего названия Египта — Kham и, следовательно, должно означать «египетское искусство». Согласно другой теории, слово «химия» произошло от греческого слова cumoz (сок растения) и означает «искусство выделения соков». Этот сок может быть расплавленным металлом, так что при подобном расширенном толковании данного термина в него приходится включать и искусство металлургии.
С химией тесно связаны элементы стихий древнегреческой натурфилософии, атомистика Левкиппа и Демокрита. Но, конечно, наибольший вклад в становление этой науки внесли египтяне. Имя первого из дошедших до нас химиков — Болос из Менда, жившего в дельте Нила на рубеже III и II вв. до н.э. К 300 г. н.э. египтянин Зосима написал энциклопедию, которая охватывала все собранные к тому времени знания по химии. Но химия, представленная в этом труде, еще не была наукой в полном смысле слова, а оставалась тесно связанной с древнеегипетской религией и не выходила в своем развитии за пределы формирования феноменологического уровня. В химии выявлялись свойства, устанавливались закономерности между ними, сущность же явлений подменялась их мистической интерпретацией. Химию (химиков) искореняли и преследовали древнеримские императоры, фанатики христианства: ученые изгонялись, книги их сжигались, сама наука запрещалась. Одни опасались, например, того, что химики занимались получением золота; вторые преследовали ученых за тесную связь химии с древнеегипетской религией, которая, с точки зрения христианства, была язычеством.
Начиная с последних веков I тыс. до н.э. химия бурно развивалась в арабском мире, а в первой половине нынешнего тысячелетия она получила широкое распространение в Западной Европе. С одной стороны, развитие химии в этот период шло вслед за развитием техники, однако, с другой стороны, она оставалась тесно связанной с религиозно-философской мыслью. В тот период химия существовала главным образом как алхимия, основная задача которой - превращение неблагородных металлов в благородные. Не добившись успеха в решении этой задачи, алхимики, тем не менее, выработали ряд приемов исследования веществ, открыли некоторые химические соединения, чем в определенной степени способствовали возникновению научной химии.
Натурфилософские воззрения лежали также в основе возникшей в XVI в. ятрохимии (предшественницы медицинской химии), стремившейся найти в химических препаратах средства лечения многочисленных болезней. В средние века получили ускоренное развитие химические производства: металлургия, стеклоделие, изготовление красителей. Это способствовало выработке первых теоретических установок в развивавшемся химическом знании.
Собственно научная химия ведет свое начало со второй половины XVII в., когда Р. Бойль и его единомышленники дали первое научное определение понятия «химический элемент». Важной вехой на пути создания научной химии стало открытие благодаря работам М.В. Ломоносова и А. Лавуазье, закона сохранения массы при химических реакциях. Важную роль в становлении химии как самостоятельной науки сыграло открытие в конце XVII — начале XIX вв. стехиометрических законов.
Разработка химических воззрений в XIX в. началась с создания Д.Дальтоном основ химической атомистики. Вскоре А. Авогадро ввел понятие «молекула». Однако атомно-молекулярные представления утвердились в науке лишь в 60-х годах XIX в.. В тот же период активно проводились исследования и структуры веществ. Этому в решающей степени способствовало создание А.М.Бутлеровым теории химического строения. К числу наиболее значительных вех развития научной химии и всего естествознания принадлежит открытие Д.И.Менделеевым периодического закона химических элементов. В конце XIX — начале XX вв. одним из ведущих направлениий химии стало изучение закономерностей химического процесса. Со второй половины XX в. в химии плодотворно развивается концепция, нацеленная на изучение возможностей использования в процессах получения целевых продуктов таких условий, которые приводят к самосовершенствованию катализаторов химических реакций, т.е. к самоорганизации химических систем. Эволюционная химия обратилась к постижению путей получения наиболее высокоорганизованных химических систем, которые только возможны в настоящее время.
В химии исторически сложились, таким образом, четыре уровня изучения веществ: с позиций их состава, строения, химического действия и самоорганизации. Тем не менее, специфика химии не может быть сведена только к исследованию веществ с позиций этого многоуровневого подхода. Наиболее специфичным для нее является постижение химизма взаимоотношений веществ. Причем осмысление феномена химизма, находит свое концентрированное выражение в современной трактовке предмета химии.
Важнейшие особенности современной химии
1. В химии, прежде всего в физической химии, появляются многочисленные самостоятельные научные дисциплины (химическая термодинамика, химическая кинетика, электрохимия, термохимия, радиационная химия, фотохимия, плазмохимия, лазерная химия).
2. Химия активно интегрируется с остальными науками, результатом чего было появление биохимии, молекулярной биологии, космохимии, геохимии, биогеохимии. Первые изучают химические процессы в живых организмах, геохимия — закономерности поведения химических элементов в земной коре. Биогеохимия — это наука о процессах перемещения, распределения, рассеяния и концентрации химических элементов в биосфере при участии организмов. Основоположником биогеохимии является В. И. Вернадский. Космохимия изучает химический состав вещества во Вселенной, его распространенность и распределение по отдельным космическим телам.
3. В химии появляются принципиально новые методы исследования (структурный рентгеновский анализ, масс-спектроскопия, радиоспектроскопия и др.).
Химия способствовала интенсивному развитию некоторых направлений человеческой деятельности. Например, хирургии химия дала три главных средства, благодаря которым, современные операции стали безболезненными и вообще возможными: 1) введение в практику эфирного наркоза, а затем и других наркотических веществ; 2) использование антисептических средств для предупреждения инфекции; 3) получение новых, не имеющихся в природе аллопластических материалов-полимеров.
В химии весьма отчетливо проявляется неравноценность отдельных химических элементов. Подавляющее большинство химических соединений (96% из более 8,5 тыс. известных в настоящее время) — это органические соединения. В их основе лежат 18 элементов), и большее распространение имеют всего 6 из них). Это происходит в силу того, что, во-первых, химические связи прочны (энергоемки) и, во-вторых, они еще и лабильны. Углерод как никакой другой элемент отвечает всем этим требованиям энергоемкости и лабильности связей. Он совмещает в себе химические противоположности, реализуя их единство.
Однако подчеркнем, что материальная основа жизни не сводится ни к каким, даже самым сложным, химическим образованиям. Она не просто агрегат определенного химического состава, но одновременно и структура, имеющая функции и осуществляющая процессы. Поэтому невозможно дать жизни только функциональное определение.
В последнее время химия все чаще предпринимает штурм соседних с нею уровней структурной организации природы. Например, химия все более и более вторгается в биологию, пытаясь объяснить основы жизни.
Предмет химии
Современная химия изучает возможность и условия взаимодействия веществ, а также все, что определяет их химические совйства: состав, внутреннее строение, внешние воздействия. Таким образом, химия – наука о веществах, их строении, свойствах и превращениях.
Структура химии
До конца XIX века химия в основном была целостной единой наукой. Внутреннее ее деление на органическую и неорганическую не нарушало этого единства. Но последовавшие вскоре многочисленные открытия, как в самой химии, так и в биологии, физике положили начало быстрой ее дифференциации.
Уже к началу XX в. внутри самой химии четко различаются общая и неорганическая химия, и органическая химия. Предметом изучения общей и тесно связанной с ней неорганической химии стали химические элементы, образуемые ими простейшие неорганические соединения и их общие законы (прежде всего Периодический закон Д.И. Менделеева).
Сильный толчок развитию неорганической химии дали проникновение в недра атома и изучение ядерных процессов. Поиски элементов, наиболее пригодных для расщепления в ядерных реакторах, способствовали исследованию малоизученных и синтезу новых элементов с помощью ядерных реакций. Изучением их свойств, а также физико-химических основ и химических свойств радиоактивных изотопов, методикой их выделения и концентрации занялась радиохимия, возникшая во второй четверти XX в.
В XX в. многие разделы органической химии стали постепенно превращаться в большие, относительно самостоятельные ветви со своими объектами изучения. Так появились химия элементоорганических соединений, химия полимеров, химия высокомолекулярных соединений, химия антибиотиков, красителей, душистых соединений, фармакохимия и т.д.
В конце XX в. возникает химия металлоорганических соединений, то есть соединений, содержащих одну (или более) прямую связь металла с углеродом. До окончания века были открыты органические соединения ртути, кадмия, цинка, свинца и др. В настоящее время получены углеродистые соединения со значительным содержанием не только металлов, но и неметаллов (фосфор, бор, кремний, мышьяк и т.д.). Теперь эту область химии стали называть химией элементоорганических соединений, она находится на стыке органической и неорганической химии.
Самостоятельной областью химии является наука о методах определения состава вещества — аналитическая химия. Ее основная задача — определение химических элементов или их соединений, входящих в состав исследуемого вещества, — решается путем анализа. Без современных методов анализа был бы невозможен синтез новых химических соединений, эффективный постоянный контроль за ходом технологического процесса и качеством получаемых продуктов.
В сфере соприкосновения физики и химии возник и успешно развивается такой сравнительно молодой раздел из числа основных разделов химии как физическая химия, которая оформилась в конце XIX в. в результате успешных попыток количественного изучения физических свойств химических веществ и смесей, теоретического объяснения молекулярных структур. Экспериментальной и теоретической базой для этого послужили работы Д.И. Менделеева (открытие Периодического закона), Вант-Гоффа (термодинамика химических процессов), С.Аррениуса (теория электролитической диссоциации) и т.д. Предметом ее изучения стали общетеоретические вопросы, касающиеся строения и свойств молекул химических соединений, процессов превращения веществ в связи с взаимной обусловленностью их физическими свойствами, изучение условий протекания химических реакций и совершающихся при этом физических явлений. Сейчас физхимия — это разносторонне разветвленная наука, тесно связывающая физику и химию.
В самой физической химии к настоящему времени выделились и вполне сложились в качестве самостоятельных разделов, обладающих своими особыми методами и объектами исследования, электрохимия, учение о растворах, фотохимия, кристаллохимия. В начале XX в. выделилась также в самостоятельную науку выросшая в недрах физической химии коллоидная химия. Со второй половины XX в. в связи с интенсивной разработкой проблем ядерной энергии возникли и получили большое развитие новейшие отрасли физической химии — химия высоких энергий, радиационная химия (предметом ее изучения являются реакции, протекающие под действием ионизирующего излучения), химия изотопов.
Еще одним свидетельством плодотворности влияния физики на химическую науку является все расширяющееся применение физических методов в химических исследованиях. Поразительный прогресс в этой области особенно отчетливо виден на примере спектроскопических методов. Еще совсем недавно из бесконечного диапазона электромагнитных излучений химики использовали лишь узкую область видимого и примыкающего к нему участков инфракрасного и ультрафиолетового диапазонов. Открытие физиками явления магнитного резонансного поглощения привело к появлению спектроскопии ядерного магнитного резонанса, наиболее информативного современного аналитического метода и метода изучения электронного строения молекул, и спектроскопии электронного парамагнитного резонанса, уникального метода изучения нестабильных промежуточных частиц - свободных радикалов. В коротковолновой области электромагнитных излучений возникла рентгеновская и гамма-резонансная спектроскопия, обязанная своим появлением открытию Мессбауэра. Освоение синхротронного излучения открыло новые перспективы развития этого высокоэнергетического раздела спектроскопии.
Казалось бы, освоен весь электромагнитный диапазон, и в этой области трудно ждать дальнейшего прогресса. Однако появились лазеры — уникальные по своей спектральной интенсивности источники — и вместе с ними принципиально новые аналитические возможности. Среди них можно назвать лазерный магнитный резонанс — быстро развивающийся высокочувствительный метод регистрации радикалов в газе. Другая, поистине фантастическая возможность — это штучная регистрация атомов с помощью лазера — методика, основная на селективном возбуждении, позволяющая зарегистрировать в кювете всего несколько атомов посторонней природы. Поразительные возможности для изучения механизмов радикальных реакций дало открытие явления химической поляризации ядер.
Науки, возникшие на стыке биологии, химии и физики: биохимия — наука об обмене веществ и химических процессов в живых организмах; биоорганическая химия — наука о строении, функциях и путях синтеза соединений, составляющих живые организмы; физико-химическая биология как наука о функционировании сложных систем передачи информации и регулировании биологических процессов на молекулярном уровне, а также биофизика, биофизическая химия и радиационная биология.
Крупнейшими достижениями этих разделов химии стали определение химических продуктов клеточного метаболизма (обмена веществ в растениях, животных, микроорганизмах), установление биологических путей и циклов биосинтеза этих продуктов; был реализован их искусственный синтез, сделано открытие материальных основ регулятивного и наследственного молекулярного механизма, а также в значительной степени выяснено значение химических процессов в энергетике процессов клетки и живых организмов в целом.
Более столетия назад ученые поняли, что основой исключительной эффективности биологических процессов является биокатализ. Поэтому химики ставят своей целью создать новую химию, основанную на каталитическом опыте живой природы. В ней появится новое управление химическими процессами, где начнут применяться принципы, синтеза себе подобных молекул, по принципу ферментов будут созданы катализаторы с таким разнообразием качеств, которые далеко превзойдут существующие в нашей промышленности.
В настоящее время уже видны перспективы возникновения и развития новой химии, на основе которой будут созданы малоотходные, безотходные и энергосберегающие промышленные технологии.
Сегодня химики пришли к выводу, что, используя те же принципы, на которых построена химия организмов, в будущем (не повторяя в точности природу) можно будет построить принципиально новую химию, новое управление химическими, процессами, где начнут применяться принципы синтеза себе подобных молекул. Предвидится создание преобразователей, использующих с большим КПД солнечный свет, превращая его в химическую и электрическую энергию, а также химическую энергию в свет большой интенсивности.
Для освоения каталитического опыта живой природы и реализации полученных знаний в промышленном производстве химики наметили рад перспективных путей.
Первый — развитие исследований в области металлокомплексного катализа с ориентацией на соответствующие объекты живой природы. Этот катализ обогащается приемами, которыми пользуются живые организмы в ферментативных реакциях, а также способами классического гетерогенного катализа.
Второй путь заключается в моделировании биокатализаторов. В настоящее время за счет искусственного отбора структур удалось построить модели многих ферментов характеризующихся высокой активностью и селективностью, иногда' почти такой же, как и у оригиналов, или с большей простотой строения.
Правда, пока все же полученные модели не в состоянии заменить природные биокатализаторы живых систем. На данном этапе развития химических знании проблема эта решается чрезвычайно сложно. Фермент выделяется из живой системы, определяется его структура, он вводится в реакцию для осуществления каталитических функций. Но работает непродолжительное время и быстро разрушается, поскольку является выделенным из целого, из клетки. Цельная клетка со всем ее ферментным аппаратом — более важный объект, чем одна, выделенная из нее деталь.
Третий путь к освоению механизмов лаборатории живей природы связывается с достижениями химии иммобилизованных систем. Сущность иммобилизации состоит в закреплении выделенных из живого организма ферментов на твердой поверхности путем адсорбции, которая и превращает их в гетерогенный катализатор и обеспечивает его стабильность и непрерывное действие.
Четвертый путь в развитии исследований, ориентированных на применение принципов биокатализа в химии и химической технологии, характеризуется постановкой самой широкой задачи — изучением и освоением всего каталитического опыта живой природы, в том числе и формирования фермента, клетки и даже организма. Это ступень, на которой основы эволюционной химии как действенной науки с ее рабочими функциями. Ученые утверждают, что это движение химической науки к принципиально новой химической технологии с перспективой создания аналогов живых систем. Решение названной задачи займет важнейшее место в создании химии будущего.
Задачи современной химии:
создание безотходных производств и экологически безвредных технологий переработки природного сырья в вещества и материалы, используемые в повседневной практиеской деятельности (металлы, сплавы, топливо, удобрения и др.);
создание искусственных веществ с заранее заданными свойствами (пластмассы, лекарственные препараты);
использование энергии химичеких превращений (создание миниатюрных и долговечных источников тока).
Основные понятия химии
Атом - электронейтральная частица, состоящая из положительно заряженного ядра и компенсирующих его заряд электронов.
Химический элемент - каждый отдельный вид атомов, характеризующийся определенным положительным зарядом ядра.
В настоящее время известно 107 химических элементов. Каждый из них условно обозначается символом элемента, или химическим знаком. Символ элемента представляет собой одну или две буквы латинского названия химического элемента.
-
Русское название
Латинское название
Символ элемента
Водород
Hydrogenium
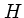
Кислород
Oxygenium
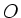
Золото
Aurum
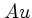
Символ элемента обозначает:
Название элемента.
Один атом элемента.
Один моль атомов этого элемента.
С помощью цифры, стоящей впереди символа элемента, можно обозначить число атомов или молей атомов данного элемента, например:
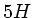 -
пять атомов элемента водорода, пять
моль атомов элемента водорода;
-
пять атомов элемента водорода, пять
моль атомов элемента водорода;
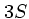 -
три атома элемента серы, три моль атомов
серы.
-
три атома элемента серы, три моль атомов
серы.
С помощью цифр, расположенных слева или справа, вверху или внизу от символа элемента, можно обозначить атомную массу элемента, порядковый номер, заряд иона или число атомов в молекуле.

Например:
Н2- молекула водорода, состоящая из двух атомов водорода.
Сu2+- ион меди с зарядом 2+.
![]() -
атом углерода с зарядом ядра, равным 6
и атомной массой, равной 12.
-
атом углерода с зарядом ядра, равным 6
и атомной массой, равной 12.
Молекула - наименьшая частица химического вещества, обладающая всеми его химическими свойствами.
По современным представлениям из молекул состоят лишь вещества, находящиеся в парообразном и газообразном состоянии. Среди веществ, сохраняющих молекулярную структуру в твердом состоянии можно назвать воду, оксид углерода (IV), многие органические вещества. Такие вещества характеризуются низкими температурами плавления и кипения. Большинство же твердых (кристаллических) неорганических веществ состоят не из молекул, а из других частиц (ионов, атомов) и существуют в виде макротел (кристалл хлорида натрия, кусок меди и т.д.).
Простым называется вещество, молекула которого состоит из атомов одного элемента. Состав молекул веществ выражается при помощи химических формул. Например: H2, O2, N2, Cl2, F2, Br2, J2. Явление, при котором атомы одного элемента образуют два или несколько простых веществ, называется аллотропией, а простые вещества, образованные одним и тем же элементом, называются аллотропными видоизменениями (модификациями) этого элемента. Так, элемент кислород образует два простых вещества: газ кислород О2 и газ озон О3; элемент фосфор - три простых вещества: белый фосфор, красный и черный. Сложными называются вещества, молекулы которых состоят из атомов различных элементов: Н2SO4, H2O. На основании химической формулы можно дать название вещества. Химическая формула обозначает:
1 молекулу или 1 моль молекул вещества.
Из каких элементов состоит вещество (качественный состав).
Сколько атомов каждого элемента содержит молекула вещества. (Количественный состав).
Например, формула
![]() показывает:
показывает:
Это азотная кислота.
1 молекула азотной кислоты или 1 моль молекул азотной кислоты.
Молекула азотной кислоты состоит из водорода, азота и кислорода (качественный состав).
В состав молекулы азотной кислоты входят один атом элемента водорода, один атом элемента азота, три атома элемента кислорода (количественный состав).
К физическим явлениям относятся такие, при которых изменяется форма или физическое состояние. Например, переход веществ из одного физического состояния в другое (плавление стекла или свинца, испарение воды и спирта); изменение формы тела (расширение тел при нагревании и сжатие при охлаждении) и т.д. Явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, называются химическими явлениями или химическими реакциями. К химическим явлениям относятся: образование ржавчины на металлах под влиянием влаги или кислорода, воздуха; гниение растительных и животных остатков, а также получение кислот, щелочей и солей.
Основные законы химии
Атомно-молекулярное учение. Исключительное значение для развития химии имело атомно-молекулярное учение, колыбелью которого является Древняя Греция. Атомистика древнегреческих материалистов отделена от нас 25-ве-ковым периодом, однако логика греков поражает настолько, что философское учение о дискретном строении материи, развитое ими, невольно сливается в сознании с нашими сегодняшними представлениями.
Как же зародилась атомистика? Основным научным методом древнегреческих философов являлись дискуссия, спор. Для поиска “первопричин” в спорах обсуждались многие логические задачи, одной из которых являлась задача о камне: что произойдет если начать его дробить? Большинство философов
считало, что этот процесс можно продолжать бесконечны. И только Левкип
(500—440 до н. э.) и его школа утверждали, что этот процесс не бесконечен:
при дроблении в конце концов получится такая частица, дальнейшее деление
которой будет просто невозможно. Основываясь на этой концепции, Левкипп
утверждал: материальный мир дискретен, он состоит из мельчайших частиц и
пустоты.
Ученик Левкиппа Демокрит (460—370 до н. э.) назвал мельчайшие частицы
“неделимые”, что по-гречески значит “атом”. Это название мы используем и
сегодня. Демокрит, развил новое учение — “атомистику”, приписал атомам
такие “современные” свойства, как размер и форму, способность к движению.
Последователь Демокрита Эпикур (342—270 до н. э.) придал древнегреческой атомистике завершенность, предположив, что у атомов существует внутренний источник движения и они сами способны взаимодействовать друг с другом.
Все положения древнегреческой атомистики выглядят удивительно современно, и нам они, естественно, понятны. Ведь любой из нас, ссылаясь на опыт науки, может описать множество интересных экспериментов, подтверждающих справедливость любой из выдвинутых концепций. Но совершенно непонятны они были 20--25 веков назад, поскольку никаких экспериментальных доказательств, подтверждающих справедливость своих идей, древнегреческие атомисты представить не могли.
Итак, хотя атомистика древних греков и выглядит удивительно современно, ни одно из ее положений в то время не было доказано. Следовательно” атомистика, развитая Левкипом, Демокритом и Эпикуром, была и остается просто догадкой, смелым предположением, философской концепцией, но подкрепленной практикой. Это привело к тому, что одна из гениальных догадок человеческого разума постепенно была предана забвению.
Были и другие причины, из-за которых учение атомистов было надолго забыто. К сожалению, атомисты не оставили после себя систематических трудов, а отдельные записи споров и дискуссий, которые были сделаны, лишь с трудом позволяли составить правильное представление об учении в целом.
Главное же заключается е том, что многие концепции атомистики были еретичны и официальная церковь не могла их поддерживать.
Об учении атомистов не вспоминали почти 20 веков. И лишь в XVII в. идеи древнегреческих атомистов были возрождены благодаря работам французского философа Пьера Гассенди (1592—1655 гг.). Почти 20 лет он потратил; чтобы восстановить и собрать воедино забытые концепции древнегреческих философов, которые он подробно изложил в своих трудах “О жизни, нравах и учении Эпикура” и “Свод философии Эпикура”. Эти две книги, в которых воззрения древнегреческих материалистов впервые были изложены систематически, стали “учебником” для европейских ученых и философов. До этого единственным источником, дававшим информацию о воззрениях Демкрита -а э п и к у р а, была поэма римского поэта Лукреция “О природе вещей”.
История науки знает немало удивительных совпадений. Вот одно из них:
возрождение древнегреческой атомистики совпадает по времени с установление
Р. Бойлем (1627—1691 гг.) фундаментальной закономерности, описывающей
изменения объема газа от его давления. Качественное объяснение фактом, наблюдаемых Бойлем, может дать только атомистика: если газ имеет дискретное строение, т. е. состоит из атомов и пустоты, то легкость его сжатия обусловлена сближением атомов в результате уменьшения свободного пространства между ними.
Первая робкая попытка применения атомистики для объяснения количественно наблюдаемых явлений природы позволяет сделать два очень важных вывода:
1. Превратившись из философской гипотезы в научную концепцию, атомистика может стать мощным инструментом, позволяющим давать единственно правильную трактовку самым разнообразным явлениям природы.
2. Для скорейшего превращения атомистики из философской гипотезы в научную концепцию доказательство существования атомов необходимо прежде всего искать при изучении газов, а не жидких и твердых веществ, которыми до этого занимались химики.
Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся исследованием газов. Тогда-то и последует каскад открытий простых веществ:
водород, кислород, азот, хлор. А несколько позже газы помогут установить те законы, которые принято называть основными законами химии. Они и позволят сформулировать основные положения атомно-молекулярного учения:
Все вещества состоят из атомов.
Атомы каждого вида одинаковы между собой, но отличаются от атомов любого другого вида.
При взаимодействии атомов образуются молекулы: гомоядерные или гетероядерные.
При физических явлениях молекулы сохраняются; при химических – разрушаются; при химических реакциях атомы в отличии от молекул сохраняются.
Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Закон сохранения массы вещества
Исключительное значение для химии имело установление закона сохранения массы, являющегося следствием всеобщего естественного закона сохранения материи и движения, сформулированного М.В.Ломоносовым (1711—1765 гг.) как всеобщий естественный закон в 1748 г. в письме к Д. Эйлеру: “Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько присовокупится к другому, ежели, где убудет несколько материи, то умножится в другом месте... Сей всеобщий закон простирается и в самые правила движения; ибо тело, движущее своей силой другое, столько же он у себя теряет, сколько сообщает другому, которое от него движение получает” (Ломоносов М. В. Труды по физике и химии.— М., 1951.—Т. II.-" С. 188).
Это положение, высказанное в виде философской концепции. М. В. Ломоносов подтвердил экспериментально в 1756 г., повторив опыты Р. Боиля по прокаливанию металлов в запаянных стеклянных сосудах (ретортах).
Русский ученый установил, что если сосуд, содержащий металл, взвесить до и после прокаливания, не вскрывая его, то масса остается без изменений. При нагревании же металла во вскрытой реторте масса увеличивается за счет его соединения с воздухом, проникающим в сосуд.
Аналогичных выводы на основе экспериментом по прокаливанию металлов
сделал в 1777 г. и А. Лавуазье (1743--1794 гг.), который (после открытия и 1774 г. Д. Пристли кислорода) уже знал качественный и количественный состав воздуха.
Современная формулировка закона сохранения массы вещества формулируется так: масса веществ, вступающих в реакцию, равна массе веществ, полученных в результате реакции. Данный закон имеет большое практическое и теоретическое значение, позволяет контролировать химические процессы. Зная количество исходных веществ реакции, всегда можно на основании этого закона вычислить количества продуктов, которые должны получиться.
В 1905 году А. Эйнштейн показал, что между массой тела (m) и его энергией (Е) существует связь, выражаемая соотношением
Е = m с2
где с – скорость света в вакууме, 2,997925 ∙108 м с-1 (или ≈ 300 000 км/с ). Это уравнение Эйнштейна справедливо как для макроскопических тел, так и для частиц микромира (электронов, протонов). При химических реакциях всегда выделяется или поглощается энергия. Поэтому при учете массы веществ необходимо принимать во внимание прирост или убыль ее, отвечающие поглощению или выделению энергии при данной реакции. Однако из-за громадного значения величины с2 тем энергиям, которые выделяются или поглощаются при химических реакциях, отвечают очень малые массы, лежащие вне пределов возможности измерений. Поэтому при химических реакциях можно не принимать во внимание ту массу, которая приносится или уносится с энергией.
Закон постоянства состава. Французский ученый Пруст в конце XVIII века тщательно изучал количественный состав многих сложных веществ. Он пришел к заключению, что всякое химическое соединение имеет постоянный состав и одни и те же свойства (1799). Эти представления получили признание только после победы Пруста в семилетнем споре с другим французским химиком - Бертолле, который, в противоположность Прусту, доказывал, что состав всякого сложного вещества может колебаться в зависимости от условий его образования и особенно от количества веществ, взятых для его получения. Для подтверждения закона Пруст получил воду несколькими различными способами и выяснил, в каком весовом соотношении соединены водород и кислород в воде. Для любого из способов справедливо следующее соотношение: на 2 весовые части H приходится 16 весовых частей O, 1 вес. ч. H - x вес. ч. О. X = 16 ∙ 1/2 = весовых частей кислорода. Была принята следующая формулировка закона постоянства состава: каждое химическое соединение имеет вполне определенный и постоянный состав независимо от способа его получения. Вещества, имеющие постоянный состав имеют молекулярную структуру и называются дальтонидами.
Закон кратных отношений. Если два элемента образуют друг с другом
несколько химических соединений, то на одну и ту же массу одного из них
приходятся такие массы другого, которые относятся между собой как простые целые числа (Д. Дальтон, 1803 г.).
Д. Дальтон (1776—1844 гг.) в дальнейшем, используя открытый им закон кратных отношений, закон эквивалентов и закон постоянства состава, создал новую версию атомистической теории, основанную на количественных соотношениях, возникающих при взаимодействии между химическими элементами.
Нетрудно убедиться, что закон кратных отношений представляет собой дальнейшее развитие закона эквивалентов, основанное на последовательном анализе рядов химических соединений, образующихся при взаимодействии друг с другом двух любых химических элементов. В простейшем случае указанный ряд может состоять из двух соединений. Например, при взаимодействии углерода и кислорода: образуются два соединения: оксид углерода (II) и оксид углерода (IV).
Рассчитав массу кислорода, соединяющуюся с одним и тем же количеством углерода при образовании этих оксидов, мы получим, что на одну единицу массы углерода в диоксиде углерода приходится ровно в 2 раза больше кислорода, чем в оксиде углерода (II).
Выдвигая новую версию атомистической теории, опирающуюся на основные химические законы, и отдавая дань уважения древнегреческим философам атомистам, Д. Дальтон сохранил предложенное ими название для мельчайших неделимых частиц материи — атом.
Использование закона постоянства состава и закона кратных отношений позволило Д. Дальтону установить значения относительных атомных масс элементов, принимая за единичную — массу атома водорода. Так, атом Дальтона, обладающий конкретным материальным свойством — атомной массой, из отвлеченной модели превратился в конкретное химическое понятие. С введением в химию понятия “атомная масса” наука переходит на более высокую ступень своего развития.
Вместе с тем атомистика Дальтона еще не свободна от недостатков: в ней
нет места молекулам, а существуют только “сложные атомы ”.
Открытия, сделанные гораздо позднее показали относительность закона постоянства состава и закона кратных отношений. Выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. Например, тяжелая вода содержит 20% (масс.) водорода, а обычная вода лишь 11%. В начале 20 века Н.С.Курнаков, изучая сплавы металлов, открыл соелинения переменного состава. В этих соединениях на единицу массы данного элемента может приходится различная масса другого элемента. А позднее выяснилось, что соединения, не имеющие молекулярную структуру ( атомную, ионную) имеют переменный состав, а следовательно к ним не применим закон кратных отношений. Такие соединения называют бертоллиды.
Закон объемных отношений и закон Авогадро. Объемы вступающих в реакцию газов относятся друг к другу, а также к объему получающихся газообразных продуктов как простые целые числа (Ж. Гей-Люссак, 1805 г.). Этот закон находится в серьезном противоречии с выводами атомистики Дальтона.
Для объяснения наблюдавшихся Ж. Гей-Люссаком закономерностей соединения газов оказалось необходимым предположить следующее:
1) любые газы (в том числе и простые) состоят не из атомов, а из
молекул;
2) в равных объемах различных газов при одинаковых температуре и
давлении содержится одинаковое число молекул.
Последнее утверждение, высказанное итальянским ученым А. А вогадро в
1811 г., вошло в химию под именем закона Авогадро. Однако в начале XIX в.
эти воззрения не получили должного признания: даже крупные химики того
времени Д. Дальтон и И. Берцелиус отрицали возможность существования
молекул, состоящих из нескольких одинаковых атомов. Прошло еще полвека,
прежде чем на 1 Международном съезде химиков, состоявшемся в Карлсруэ
(Германия) в сентябре 1860 г., были окончательно приняты основные химические представления (понятия об атомах и молекулах), зародившиеся в виде философского учения в Древней Греции (Левкипп, Демокрит, Эпикур), впервые развитые в виде научной концепции Д. Дальтоном, подтвержденные опытами Ж. Пруста, Ж. Гей-Люссака и окончательно сформулированные в трудах А.Авогадро и его ученика С.Канниццаро.
Моль - это количеству вещества, содержащего столько же структурных частиц данного вещества, сколько атомов содержится визотопе углерода-12 массой 12 г.
Для удобства расчетов, проводимых на основании химических реакций и
учитывающих количества исходных реагентов и продуктов взаимодействия в молях, вводится молярная масса вещества.
Молярная масса М вещества представляет собой отношение его массы к
количеству вещества: М =m/ V
где m — масса в граммах, v — количество вещества в молях, М — молярная
масса в г/моль — постоянная величина для каждого данного вещества.
Значение молярной массы численно совпадает с относительной молекулярной массой вещества или относительной атомной массой элемента. Определение, данное молю, опирается на число структурных частиц, содержащихся в 12 г углерода. Было установлено, что указанная масса углерода содержит 6,02·1023 атомов этого элемента. Следовательно, любой химический индивид количеством 1 моль содержит 6,02·1023 структурных частиц (атомов или молекул).
Число NA=6.02·1023 носит название постоянной Авогадро и выведено с использованием закона Авогадро.
Из закона Авогадро следует, что два газа одинаковых объемов при одинаковых условиях, хотя и содержат одинаковое число молекул, имеют неодинаковые массы: масса одного газа во столько раз больше массы другого, во сколько раз относительная молекулярная масса первого больше, чем относительная молекулярная масса второго, т. е. плотности газов относятся как их относительные молекулярные массы.
Д = m1/m2 , где m1 –масса данного газа, m2 – масса газа, по которому измеряется плотность, Д - относительная плотность газа.
Независимая оценка значения молярной массы М может быть проведена на
основании обобщенного уравнения Клапейрона — Менделеева:
PV = m · R · T/ M
Где Р – давление газа в замкнутой системе, V – объем системы, m –масса газа, R – молярная газовая постоянная, равная 8,314 ДЖ/К·моль, Т – абсолютная температура.
Закон сохранения энергии. Закон сохранения энергии формулируется так: энергия не возникает вновь и не исчезает, она лишь переходит из одного вида в другой. Так, тепловая энергия может переходить в электрическую, в механическую и наоборот и т.д.
Различают следующие виды энергии: механическую, тепловую, магнитную, электрическую, лучистую, химическую (потенциальную) и др..
Химической называется энергия, которая находится в веществах в скрытом состоянии и освобождается только при химических реакциях. Непосредственно химическую энергию, содержащуюся в веществе, измерить нельзя, поэтому ее относят к потенциальной энергии. При химических реакциях происходит не только изменение состава взаимодействующих веществ, но также изменение энергии. Если получающиеся вещества содержат меньше химической энергии, чем исходные, то этот избыток превращается в эквивалентное количество энергии другой формы: механической, световой, тепловой, электрической. Количество тепла, которое выделяется или поглощается при образовании или разложении моля вещества, называется тепловым эффектом реакции и выражается в килокалориях (ккал).
Все виды энергии, в том числе и химическая, легче всего превращается в тепловую, поэтому при химических реакциях чаще всего наблюдается выделение или поглощение тепла. Тепловой эффект реакции принято обозначать через Δ H и выражать в килокалориях (ккал) или в килоджоулях (кДж), и относить к 1 молю вещества. Знаки тепловых эффектов считаются отрицательными у экзотермических процессов (теплота выделяется) и положительными у эндотермических процессов (теплота поглощается).
Экзотермической называется реакция, протекающая с выделением энергии. Выделение энергии обозначают Δ H со знаком минус:
2H2 + O2 = 2H2O ( Δ H = – 68,4 ккал\моль). В полученном при экзотермической реакции веществе энергии меньше, чем в исходных веществах. Экзотермические вещества устойчивы по отношению к нагреванию. Чем больше выделяется тепла при его образовании, тем труднее оно разлагается. Количество тепла, выделяющегося при образовании вещества, может служить мерой прочности вещества: сколько выделяется тепла при образовании вещества (воды), столько тепла нужно затратить, чтобы разложить вещество на составные части (водород и кислород), чтобы полученные вещества сохраняли прежний запас химической энергии.
При образовании оксидов и сульфидов, как правило, выделяется много тепла, поэтому земная кора состоит из оксидов и сульфидов – веществ, устойчивых к нагреванию.
Уравнения реакций, включающие, кроме формул веществ, тепловой эффект реакции, называются термохимическими. Приведенное выше уравнение реакции горения водорода термохимическое.
Эндотермической называется реакция, протекающая с поглощением энергии, т.е. требующая нагревания. Знак теплового эффекта в эндотермической реакции положительный. Примером может служить реакция образования йодоводорода: H2 + J2 = 2HJ(Δ H = + 6 ккал).
В полученном при эндотермической реакции веществе энергии больше, чем в исходных. Эндотермические вещества неустойчивы к нагреванию, причем, чем больше энергии поглощается при образовании вещества, тем менее устойчиво вещество к нагреванию.
Следствие из закона сохранения энергии: если реакция идет с выделением тепла, то обратный процесс пойдет с поглощением тепла: a) 2H2O = 2H2 + O2 (Δ H = +68,4 ккал), б) 2H2 + O2 = 2H2 (Δ H = -68,4 ккал).
Закон эквивалентов. Химические элементы соединяются друг с другом в
строго определенных количествах, соответствующих их эквивалентам (В.Рихтер, 1792—1794 гг.). Понятие эквивалента введено в химию для сопоставления соединительной способности различных элементов. Эквивалентомхимического элемента называют такую его массу, которая соединяется с 1,008 ч. м. (части массы) водорода или 8 ч. м. кислорода или замещает эти массы в соединениях. Отметим, что один и тот же элемент может иметь не один, а несколько эквивалентов. Так, эквивалент углерода в оксиде углерода (IV) равен трем, а в оксиде углерода (II) — шести.
Понятие эквивалента можно распространить и на сложные соединения типа
кислот, солей и оснований. Эквивалентом сложного соединения называют массу этого соединения, содержащую эквивалент водорода (кислоты) или эквивалент металлической составной части (основания, соли).
В общем виде закон эквивалентов можно сформулировать следующим
образом: во всех химических реакциях взаимодействие различных веществ друг с другом происходит в соответствии с их эквивалентами, независимо от того, являются ли эти вещества простыми или сложными.
Введение понятия «эквивалент» значительно упрощает некоторые расчеты в теоретических и практических задачах по химии.
Согласно современным рекомендациям эквивалент – это реальная частица, или условная единица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или 1 электрону в окислительно-восстановительных реакциях ( О.С. Зайцев. Методика обучения химии. Учебник для студентов высших учебных заведений. 1999г.).
Эквивалент величина безразмерная, а его состав выражают с помощью знаков и формул:
Э(Х) = 1/z Х, где Х – формульная единица вещества; 1/z – фактор эквивалентности, а z – эквивалентное число, равное суммарному заряду ионов одного знака, обмениваемых структурной единицей вещества, или числу электронов, принимаемых или отдаваемых структурной единицей.
Для того, чтобы определить состав эквивалентов вещества и правильно записать его формулу необходимо исходить из конкретной реакции, в которой участвует данное вещество.
Например, в реакциях нейтрализации
КОН + Н3РО4 = КН2РО4 + Н2О
Э(Н3РО4) = 1 Н3РО4; Э(КОН) = 1 КОН; Э(КН2РО4) = 1 КН2РО4
2КОН + Н3РО4 = К2НРО4 +2Н2О
Э(Н3РО4) = 1/2 Н3РО4; Э(КОН) = 1/2 КОН; Э(К2НРО4) = 1/2 К2НРО4
3КОН + Н3РО4 = К3РО4 +3Н2О
Э(Н3РО4) = 1/3 Н3РО4; Э(КОН) = 1/3 КОН; Э(К3РО4) = 1/3 К3РО4
Т.е. Экислоты = 1/ число замещаемых в реакции ионов Н+.
Эоснования = 1/число замещаемых в реакции ОН-.
Эсоли = 1/число ионов Н+ или ОН-, участвующих в процессе.
В реакции окисления-восстановления
Эокислителя = 1/ число электронов, принятых одной
формульной единицей окислителя
Эвосстановителя = 1/ число электронов, отданных одной
формульной единицей восстановителя.
Например, в реакции
4) Мg + 2HCl = MgCl2 + H2
Э(Мg) = ½ Мg ; Э(HCl) = 1(HCl) ; Э(MgCl2) = ½ MgCl2 ; Э(H2) = ½ H2
Поскольку эквивалент есть реальная или условная частица вещества, для него характерны понятия : количество вещества эквивалента и молярная масса эквивалента. Единицей количества вещества эквивалента является моль. 1 моль эквивалентов – это количество вещества, содержащего 6,02·1023 эквивалентов.
Массу одного моля эквивалентов называют молярной массой эквивалентов вещества МЭ(Х), г/моль.
Например, в рассмотренной реакции (4)
МЭ(Мg) = ½ · М(Мg) = ½ · 24 = 12 (г/моль) ; МЭ(HCl) = 1· М(HCl) = 36,5 (г/моль) МЭ(MgCl2) = ½ М(MgCl2) = ½ · 95 = 47,5 (г/моль) ;
МЭ(H2) = ½ · М(H2) = ½ · 2 = 1 (г/моль)
При расчете молярной массы эквивалентов вне конкретной реакции допускается использование следующих формул:
для элементов МЭ(Х) = М(Х)/В , где
М(Х) – молярная масса атома элемента (г/моль);
В – валентность элемента в данном химическом соединении.
для простого вещества МЭ(Х) = М(Х) / В, где
МЭ(Х) – молярная масса атома данного вещества (г/моль);
В – валентность атома
3) для сложного вещества МЭ(Х) = М(Х) / В · n , где
МЭ(Х) – молярная масса данного вещества (г/моль);
В – валентность функциональной группы
n – число функциональных групп в молекуле.
Для кислот функциональной группой является ион Н+, для оснований – ОН-, для солей – ион металла.
Для газов наряду с молярной массой эквивалента используется понятие молярный объем эквивалента.
Т.к. моль любого газа при н.у. (Т = 273К, Р = 101,3 кПа или 760мм рт. ст.) занимает объем, равный 22,4л, то объем одного моля эквивалентов газа при н.у. будет равен Vm (1/z X) = 1/z · 22,4 (л/моль)
Например, Э(Н2) = ½ Н2 Vm ( ½ Н2) = 22,4 : 2 = 11,2 (л/моль).
Количественные отношения веществ в реакциях, выражаемые эквивалентами, определяет закон эквивалентов: в химической реакции вещества реагируют в равных количествах вещества эквивалентов веществ
n(1/z X1) = n (1/z X2) или n(Э(X1) = n (Э(X2)
Из этого следует, что
массы реагирующих в реакции веществ пропорциональны молярным массам их эквивалентов: m1 Mэ1
---- = ----
m2 Mэ2
Объемы газов, участвующих в реакции относятся как молярные объемы их эквивалентов: V(X1) Vm (1/z1 X1)
--------- = ------------------
V(X2) Vm (1/z2 X2)
Для веществ, находящихся в растворе, закон эквивалентов принимает следующий вид: Сэкв.(1) · V1 = Сэкв.(2) · V2 , где
Сэкв.(1) и Сэкв.(2) – молярные концентрации эквивалентов растворов реагирующих веществ, моль/л или н.;
V1 и V 2 - объемы растворов реагирующих веществ, л.
Молярная концентрация эквивалента показывает число молей эквивалентов растворенного вещества, содержащегося в 1л раствора.
n(1/z X)
С(1/z X) = ------------ где,
V
С(1/z X) – молярная концентрация эквивалента, моль/л или н.;
n(1/z X) – число молей эквивалентов растворенного вещества, моль;
V – объем раствора вещества, л.
Раствор, содержащий 1 моль эквивалента вещества в 1л, называется нормальным раствором этого вещества. Допускается применение и десятичных долей нормальности растворов. Например, если в реакции
НСl + KOH = H2O + KOH
в 0,5л раствора соляной кислоты содержится 3,65 НСl, то
М (НСl) = 36,5 (г/моль); nЭ(НСl) = 3,65г : 36,5 г/моль = 0,1 моль
Сэкв(НСl ) = 0,1моль : 0,5л = 0,2 (моль/л) или 0,2н. НСl (f = 1) Примеры решения типовых задач
Пример 1. В состав метана входит 75% углерода и 25% водорода. Определите молярную массу эквивалента углерода.
Решение. Указанное процентное содержание углерода и водорода обозначает, что в 100 весовых частях вещества содержится 75 весовых частей углерода и 25 весовых частей водорода. Следовательно, в метане углерод и водород соединены в весовом отношении 75:25. Это отношение должно равняться отношению их эквивалентов. На 75 весовых частей С приходится 25 весовых частей Н x вес. ч. С - 1 вес. ч. H. Отсюда М(Эc) = 75 · 1/ 25 = 3 г/моль.
Пример 2. Определить молярную массу эквивалента магния, если 3 весовые части его присоединяют 2 весовые части кислорода. Решение. Так как эквивалент кислорода всегда равен 8, можно написать 3 вес. ч. Mg присоединяют 2 вес. ч. О x вес. ч. Mg - 8 вес. ч. О М(ЭMg) = 3 · 8/ 2 = 12 г/моль.
Пример 3. Определить молярную массу эквивалента серной кислоты, если 2г магния реагируют без остатка с 8,17 г серной кислоты и молярная масса эквивалента магния равен 12г/моль.
Решение. Согласно закона эквивалентов
m (Mg) : M (Э (Mg)) = m (H2SO4) : M(Э(H2SO4)), откуда
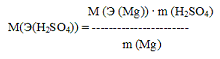
M(Э(H2SO4)) = 12г/моль · 8,17г : 2г = 49,02 (г/моль)
Пример 4. В стратосфере на высоте 20-30 км находится слой озона O3, защищающий Землю от мощного ультрафиолетового излучения Солнца. Если бы не "озоновый экран" в атмосфере, то фотоны с большой энергией достигли бы поверхности Земли и уничтожили на ней все живое. Подсчитано, что в среднем на каждого жителя Москвы в воздушном пространстве над городом (вплоть до верхней границы стратосферы) приходится по 150 моль озона. Сколько молекул O3 и какая масса озона приходится в среднем на одного москвича?
Решение. Запишем условие задачи в формульном виде:
n(O3) = 150 моль
M(O3) = 48 г/моль
NA = 6,02 . 1023 моль--1
N(O3) = ?
m(O3) = ?
В решении задачи используется уравнение, связывающее между собой число частиц N(O3) в данной порции вещества n(O3) и число Авогадро NA, а именно:
n(O3) = N(O3) / NA;
отсюда:
N(O3) = n(O3) . NA = 150 . 6,02 . 1023 [моль . моль--1] =
= 9,03 . 1025 m(O3) = n(O3) . M(O3) = 150 . 48 [моль . г/моль] =
= 7200 г = 7,2 кг
Ответ. В воздушном пространстве над городом на каждого москвича приходится 7,2 кг озона, или 9,03 . 1025 молекул O3.
Пример 5. Масса одного литра азота при н.у. равна 1,251г. Вычислите плотность газа по воздуху и водороду.
Решение. М(Н2) = 2 г/моль; Мвоздуха = 29 г/моль
М = m ·Vm/V V = 1,251 · 22,4 / 1 = 28 г/моль
D N2/H2 = M N2/ M H2 = 28: 2 = 14
D H2/возд. = = M N2/ Mвозд = 28 : 29 = 0,93
Ответ. Плотность азота по водороду = 14 и по воздуху = 0,93
Пример 6. Вычислите относительную молекулярную массу смеси с объемной долей метана 0,8 и о,2 кислорода, используя значения относительной плотности этих газов по водороду.
Решение. Молекулярную массу смеси газов можно рассматривать как среднеарифметическое молекулярных масс составных частей с учетом их объемных долей. Так как решение необходимо дать через относительную плотность по водороду, определяем ее у составных частей смеси.
Д СН4/Н2 = 18 : 2 = 9; Д О2/Н2 = 32 : 2 = 16
Д смеси = (8· 80 + 16 · 20) : 100 = 9,6
М смеси = Д смеси · 2 = 9,6 · 2 = 19,2 г/моль
Ответ : молярная масса смеси 19,2 г/моль
Пример 7. Круговорот азота в природе включает: а) "биологическую фиксацию" при помощи клубеньковых бактерий и б) процессы окисления при атмосферных электрических разрядах. Во время грозы в воздухе образуется некоторое количество оксида азота неизвестного состава. Установлено, что абсолютная масса одной молекулы этого оксида азота составляет 4,99 . 10--23 г. Определите, какова формула этого вещества.
Решение. Чтобы установить формулу оксида азота NXOY, который получается во время грозы, достаточно узнать молярную массу этого соединения. Известные к настоящему времени оксиды азота состава N2O, NO, N2O3, NO2, N2O4 и N2O5 имеют молярные массы, равные соответственно 44, 30, 76, 46, 92 и 108 г/моль.
Запишем условие задачи в формульном виде:
Mмол(NXOY) = 4,99 . 10--23 г
NA = 6,02 . 1023 моль--1
M(NXOY) = ?
Запишем уравнение, связывающее между собой молярную массу оксида азота M(NXOY), абсолютную массу молекул этого оксида Mмол(NXOY) и число АвогадроNA:
M(NXOY) = Mмол(NXOY) . NA = 4,99 . 10--23 . 6,02 . 1023
[г . моль--1] = 30 г/моль
Молярная масса, равная 30 г/моль, отвечает монооксиду азота NO.
Ответ. Формула образовавшегося во время грозы оксида азота -- NO.
Пример 8. Определите объем оксида углерода (IV) н.у., а также массу хлорида кальция, образующихся при действии соляной кислоты на 10г карбоната кальция, с массовой долей примесей 20%.
Решение. М СаСО3 = 100г/моль
СаСО3 + 2 НСl = CaCl2 + CO2
1моль 1 моль 1 моль
100г 111г 22,4 л
1) Определяем массу примесей и количество известняка чистого:
m примесей = ω % · m CaCO3 : 100 = 20 10 : 100 = 2 г
m СаСО3 = 10 -2 = 8 г
n = m / M = 8 : 100 = 0,08 моль СаСО3
2) Определяем объем, выделяемого углекислого газа. Из уравнения реакции видно, что при разложении 1 моль СаСО3 образуется 1 моль СО2, а при разложении 0,08 моль должно выделиться 0,08 моль СО2, объем которого составляет 1,792 л.
3) Находим массу хлорида кальция, образуемого в результате разложения 0,08 моль карбоната кальция. По соотношению реагирующих веществ и продуктов реакции видно, что при разложении 0,08 моль СаСО3 выделяется 0,08 моль СаСl2 масса которых составляет:
m = n M = 0,08 111 = 8,88 г СаСl2
Ответ: объем СО2 = 1,792л; масса СаСl2 = 8,88 г
Основные классы неорганических веществ.
Понятие о валентности
Валентность - свойство атома элемента присоединять определенное число атомов другого элемента. Таблица 1.1 – Валентность химических элементов
Химический элемент |
Валентность |
Химический элемент |
Валентность |
1. Li 2. Na 3. K 4. Ag 5. H 6. O 7. Ca 8. Mg 9. Zn 10. Ba 11. Cu 12. Hg 13. Fe |
I I I I I II II II II II I,II I,II II,III |
14. Mn 15. Al 16. S 17. P 18. Si 19. N 20. C 21. F 22. Cl 23. Br 24. J 25. Cr |
II-IV, VI, VII III II, IV, VI III, V IV I - V II, IV I I I I II, III, VI |
Оксиды - соединения любого элемента с кислородом (или вещества, состоящие из двух элементов, один из которых кислород): К2О СаО СО2 SO2 Al2O3
Кислоты - это вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков: Н2SO4 HNO3 H3PO4
Соли - это вещества, состоящие из атомов металлов и кислотных остатков:
СаСО3 NaCl MgSO4 Al2(SO4)3
Валентность кислотного остатка определяется или по числу атомов водорода в кислоте или по числу замещенных атомов водорода в кислоте. Основания - вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп: КОН Са(ОН)2 Al(OH)3
Классификация оксидов
1. Оксиды неметаллов - кислотные оксиды. SO2 → H2SO3, SO3 → H2SO4, CO2 → H2CO3, P2O5 → H3PO4.
2. Оксиды металлов - основные оксиды. Na2O → NaOH, CaO → Ca(OH)2, FeO → Fe(OH)2.
3 Оксиды переходных элементов - амфотерные оксиды. BeO → Be(OH)2 и H2BeO2 основание ZnO → Zn(OH)2 и H2ZnO2 и кислота, Al(OH)3 → H3AlO3 → H2O + HAlO2, Cr(OH)3 → H3CrO3 → H2O + HCrO2. Классификация кислот
Кислоты подразделяются по содержанию кислорода: 1. на кислородсодержащие, например, HNO3, H2SO4, H3PO4, 2. на бескислородные, например, H2S, HCl, HF.
По числу атомов водорода в кислотах они делятся: 1. на одноосновные: HCl, HNO3, HF, 2. на двухосновные: H2S, H2SO3, H2SiO3, 3. на трехосновные: H3PO4.
Классификация оснований 1. Растворимые в воде основания - щелочи. LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Ba(OH)2. 2. Нерастворимые в воде. Cu(OH)2, Cr(OH)3, Hg(OH)2. Классификация солей 1. Средние или нормальные соли. Na2S, CuSO4, FeCl2, CaCO3, Mg(NO3)2. 2. Кислые соли. KHS (кислота H2S) - гидросульфид калия, NaHSO4 (кислота H2SO4) - гидросульфат натрия, NaHCO3 (кислота H2CO3) - гидрокарбонат натрия, NaH2PO4 (кислота H3PO4) - дигидрофосфат натрия, Na2HPO4 (кислота H3PO4) - гидрофосфат натрия. 3. Основные соли. Cu2(OH)2CO3 - основной карбонат меди, Mg(OH)NO3 - основной нитрат магния. Таблица 1.2– Кислоты и их соли
Формула кислоты |
Название соли |
Остаток |
Название кислоты |
HCl |
Хлорид |
I Cl |
Соляная или Хлороводородная |
HF |
Фторид |
I F |
Плавиковая или Фтороводородная |
HBr |
Бромид |
I Br |
Бромоводородная |
HJ |
Йодид |
I J |
Йодоводородная |
HNO3 |
Нитрат |
I NO3 |
Азотная |
HNO2 |
Нитрит |
I NO2 |
Азотистая |
H2CO3 |
Карбонат |
II CO3 |
Угольная |
H3PO4 |
Фосфат |
III PO4 |
Фосфорная (орто) |
HPO3 |
--- |
|
Метафосфорная |
H2S |
Сульфид |
II S |
Сероводородная |
H2SO3 |
Сульфит |
II SO3 |
Сернистая |
H2SO4 |
Сульфат |
II SO4 |
Серная |
H2SiO3 |
Силикат |
II SiO3 |
Кремниевая |
III I Соли: хлорид железа (III) - FeCl3, II II сульфат магния - MgSO4, III I нитрат алюминия - Al(NO3)3, I II карбонат калия - K2CO3,
