
- •Гідроліз солей
- •Тема електрохімія
- •7.1 Електрохімічні процеси
- •7.2 Електродні потенціали
- •7.3 Стандартний водневий електрод
- •7.4 Стандартні електродні потенціали металів у водних розчинах
- •7.5 Рівняння Нернста
- •7. 6 Класифікація електродів
- •7.7 Потенціали газових електродів
- •7.9 Гальванічні елементи
- •7.11 Електроліз
- •7.11.1 Катодні процеси
- •7.11.2 Анодні процеси
- •1. Електроліз розплавів
- •2. Електроліз водних розчинів солей
- •3. Електроліз з розчиннним анодом
- •Важливі терміни і поняття
7.5 Рівняння Нернста
Величина різниці потенціалів на межі метал-розчин залежить від
активності металу (природи металу);
активності (концентрації) йонів у розчині;
температури.
Рівняння Нернста (1889) співвідносить електродні потенціали із значеннями стандартних електродних потенціалів, якщо, як це частіше буває, активність йонів металу не дорівнює одиниці. Рівняння має вигляд:
Е
= Е0
+
 ln
ln , (7.4)
, (7.4)
де Е – електродний потенціал металу при будь-якій концентрації (активності) йонів металу;
Е0 – стандартний електродний потенціал;
R – універсальна газова стала; 8,314 Дж/моль·К;
Т – температура, К;
n – число електронів, які віддає атом металу;
F – число Фарадея, 96484, або округлено 96500 Кл/моль;
– активність йонів металу у розчині, моль/л.
Якщо перейти до десяткових логарифмів, то формула запишеться:
Е = Е0 + 2,303 lg (7.5)
При стандартній температурі 298К постійні величини (2,303 · 8,314 · 298) / 96500 дають коефіцієнт 0,059 і рівняння Нернста матиме вигляд:
Е
= Е0
+
 lg
(7.6)
lg
(7.6)
Обчислення потенціалу водневого електрода за рівнянням Нернста для води ([H+] = 10-7 моль/л) дає змогу визначити ряд металів, які може витіснити водень із води. Оскільки потенціал

то метали, значення Е0 яких більш негативні, ніж –0,41В, мають взаємодіяти з водою. Проте наявність на поверхні металу оксидної плівки заважає цій взаємодії. Тому з водою реагують метали, що стоять у ряді напруг до магнію, який взаємодіє лише з киплячою водою.
7. 6 Класифікація електродів
Всі електроди ділять на 4 типи:
1) електроди першого роду;
2) електроди другого роду;
3) йонообмінні електроди;
4) окисно-відновні електроди.
Електроди першого роду. Прикладом електродів першого роду, оборотних щодо катіона, може бути будь-який метал в розчині своєї солі:
Сu | Сu2+; Zn | Zn2+; Ag | Ag+,
а також газові електроди:
1/2Н2| Н+, 1/2С12| С1–.
Їх потенціал дорівнює:
 (7.7)
(7.7)
або
 (7.8)
(7.8)
де – а(кат.) і а(ан.) – відповідно активності катіона і аніона, моль/л.
Електроди першого роду використовують як електроди визначення. Визначаючи потенціал такого електрода, можна розрахувати активність його йонів у розчині. Наприклад, вимірюючи концентрацію йонів Н+, Сu2+, користуються водневим, срібним і мідним електродами.
Електроди другого роду. Це метал, покритий шаром своєї малорозчинної солі, що знаходиться в насиченому розчині цієї солі при наявності електроліту з однойменною аніоном. Наприклад, хлорсрібний електрод:
Ag | AgС1, КС1 – це срібна дротина, покрита хлоридом срібла і занурена в розчин хлориду калію. Під час його роботи відбуваються реакції:
Ag → Ag+ + ē i Ag+ + Cl– → AgCl
або
Ag + Cl– → AgCl + ē
Потенціал виникає на межі Ag | Аg+. Потенціал хлорсрібного електрода має знак "+" по відношенню до нормального водневого:
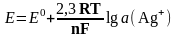
У насиченому розчині АgС1 при наявності КС1нас a (Аg+) визначається добутком розчинності AgCl, ДРАgС1:
ДРАgС1 = a (Аg+) · а (Сl–),
звідки

Тоді

Аргентумхлоридний електрод використовують як електрод порівняння.
До електродів другого роду відносять також каломельний електрод Нg | Hg2Cl2, КС1. Його до недавнього часу також використовували як електрод порівняння.
Йонообмінні електроди. Йонообмінний електрод складається з йоніту і розчину. Потенціал на межі розділу фаз виникає за рахунок йонообмінних процесів між йонітом і розчином. При постійному рівновазі обмінного процесу поверхню йоніту і розчин набувають електричні заряди протилежного знаку, на межі поділу йоніти – розчин виникає стрибок потенціалу. Найважливішим представником йонообмінних електродів є скляний електрод. В даний час це найбільш поширений електрод визначення при вимірюванні рН розчинів.
Скляний
електрод являє собою скляну трубку з
кулькою на кінці. Всередину трубки
наливають розчин НС1 з певною
 і занурюють у нього допоміжний хлорсрібний
електрод. Для вимірювання рН розчину
кульку скляного електрода опускають в
досліджуваний розчин. Наявні в склі
йони Н+
і йони лужних металів будуть обмінюватися
в розчині з йонами водню до встановлення
рівноваги. На кордоні розділу скло-розчин
на зовнішній і внутрішній поверхнях
кульки виникає стрибок потенціалу:
негативний – на склі і позитивний – в
розчині. Величина цього потенціалу
визначається активністю йонів водню,
тобто він може бути використаний замість
водневого електроду для визначення рН
розчинів:
і занурюють у нього допоміжний хлорсрібний
електрод. Для вимірювання рН розчину
кульку скляного електрода опускають в
досліджуваний розчин. Наявні в склі
йони Н+
і йони лужних металів будуть обмінюватися
в розчині з йонами водню до встановлення
рівноваги. На кордоні розділу скло-розчин
на зовнішній і внутрішній поверхнях
кульки виникає стрибок потенціалу:
негативний – на склі і позитивний – в
розчині. Величина цього потенціалу
визначається активністю йонів водню,
тобто він може бути використаний замість
водневого електроду для визначення рН
розчинів:
Ест = Е0 – 0,059рН
Скляний електрод має ряд переваг у порівнянні з водневим. Потенціал скляного електрода встановлюється миттєво, на показання електрода не впливає наявність окислювачів, відновників та інших речовин. За допомогою скляного електрода можна вимірювати рН від 0 до 12 (водневим – від 2 до 9). Недоліком скляного електроду є його крихкість і високий опір. Тому скляні електроди виготовляють із спеціального скла з підвищеною електричною провідністю, а вимірювання проводять за допомогою підсилювачів.
У сильно лужних розчинах скляний електрод поводиться як натрієвий або калієвий, оскільки обмін йонів натрію або калію в склі на йони Н+ у розчині переважає над обміном йонів Н+. Таким чином, скляний електрод може проявляти водневу і металеву функції.
До йонообмінних електродів відносяться і йоноселективні електроди, за допомогою яких визначають вміст у розчині таких йонів, як Nа+, К+, Са2+, NO3–, Ag+, Сl– тощо.
В останні роки з’явилися модифіковані йоноселективні електроди: ферментні, бактеріальні та іммуноелектроди, звані біологічними сенсорами. З їхньою допомогою визначають концентрації органічних речовин.
Окисно-відновні електроди. Окисно-відновним електродом називають електрод з інертного металу – платини, іридію, занурений в розчин, що містить окиснену і відновлену форми речовини. Під час роботи цього електрода реакції окиснення або відновлення протікають в розчині без участі речовини електрода. Електрод служить лише провідником електронів, їх резервуаром, джерелом або приймачем електронів. Продукти окиснення і відновлення не виділяються на електроді, а залишаються в розчині. Наприклад, якщо занурити платинову платівку в розчин, що містить йони Fe2+ і Fe3+, то в цьому розчині можливий процес
Fe2+ ↔ Fe3+ + ē
Йони Fe3+ можуть окиснювати різні речовини, забираючи у них електрони. Якщо таких речовин у розчині немає, то окиснення не відбувається, але тенденція приєднувати електрони у Fe3+ залишається. Платина в цьому випадку служить резервуаром вільних електронів. Забираючи у платини електрони, Fe3+ переходить у Fe2+, електрод заряджається позитивно, а поблизу його поверхні в розчині з’являється надмірна кількість аніонів (йони Fe3+ зв’язують три йони С1–, а коли утворився Fe2+ – то лише два).
Наступному йону Fe3+ важче відібрати електрон у платини, оскільки вона має позитивний заряд. Зрештою встановлюється рівновага. Виникає стрибок потенціалу характеризує окисну здатність розчину. Величина окисно-відновного потенціалу визначається за рівнянням Нернста:
 (7.9)
(7.9)
де а (окисн.) і а (відн.) – активності окисненої і відновленої форм;
 – нормальний
(стандартний) окисно-відновний потенціал
(
= Ео/в,
якщо а (окисн.) = а (відн.));
– нормальний
(стандартний) окисно-відновний потенціал
(
= Ео/в,
якщо а (окисн.) = а (відн.));
Ео/в
залежить від співвідношення
 – зі зростанням
потенціал збільшується, окисна дія
посилюється, при зменшенні цього
співвідношення Ео/в
знижується і посилюється відновна дія.
– зі зростанням
потенціал збільшується, окисна дія
посилюється, при зменшенні цього
співвідношення Ео/в
знижується і посилюється відновна дія.
Величина служить мірою окисної або відновної здатності системи: чим більше , тим сильніша її окисна властивість, і навпаки. Величина дозволяє робити висновок про напрямок реакції – окисником буде виступати та система, якої більше при контакті двох систем.
