
- •Гідроліз солей
- •Тема електрохімія
- •7.1 Електрохімічні процеси
- •7.2 Електродні потенціали
- •7.3 Стандартний водневий електрод
- •7.4 Стандартні електродні потенціали металів у водних розчинах
- •7.5 Рівняння Нернста
- •7. 6 Класифікація електродів
- •7.7 Потенціали газових електродів
- •7.9 Гальванічні елементи
- •7.11 Електроліз
- •7.11.1 Катодні процеси
- •7.11.2 Анодні процеси
- •1. Електроліз розплавів
- •2. Електроліз водних розчинів солей
- •3. Електроліз з розчиннним анодом
- •Важливі терміни і поняття
Гідроліз солей
У водних розчинах солі повністю дисоціюють на катіони і аніони. Крім них, в розчині є йони H3О+ і ОН–, що утворюються внаслідок дисоціації молекул води. Якщо під час взаємодії цих йонів з йонами солі утворюються сполуки, що погано дисоціюють (слабкі електроліти: слабкі кислоти і основи), то відбувається гідроліз солі, тобто розкладання солі водою з утворенням слабкого електроліту.
Гідроліз є результатом поляризаційної взаємодії йонів з їх гідратною оболонкою. Чим сильнішою є поляризаційна дія йонів і чим більшою є їх поляризованість, тим глибше відбувається гідроліз. Сильну поляризуючу дію здатні чинити невеликі за розмірами багатозарядні йони, як правило, це катіони слабких основ. А сильною поляризованістю характеризуються великі за розмірами аніони – кислотні залишки слабких кислот.
В результаті гідролізу зміщується рівновага електролітичної дисоціації води, що призводить до зміни рH середовища, яке можна визначити за допомогою індикаторів.
Наприклад, в результаті розчинення ацетату натрію середовище стає лужним завдяки наступним процесам:
CH3COONa ![]() Na+ +
CH3COO–
Na+ +
CH3COO–
CH3COO–+ HOH CH3COOH + OH–
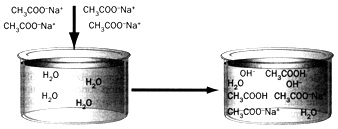
Зміна водневого показника рH під час розчинення солі у воді є основною ознакою гідролізу.
Можливість і характер гідролізу визначається природою кислоти і основи, якими утворена сіль.
1. Солі, утворені сильними основами (лугами) і сильними кислотами, не піддаються гідролізу. Розчини таких солей (NaCl, KNO3, Ва(NO3)2 та ін.) мають нейтральне середовище (рH ≈ 7).
2. Солі, утворені сильними основами і слабкими кислотами, гідролізуються за аніоном, оскільки аніон утворює з йонами гідроксонію Н3О+ слабку кислоту. Середовище розчину в цьому випадку є лужним (рН > 7) :
КСN K+ + CN–
CN–+ HOH HCN + OH–
Солі цього типу, утворені багатоосновними кислотами, гідролізуються ступінчасто, наприклад:
К2СО3 К+ +СО32–
1-й ступінь: СО32– + НОН НСО3–+ ОН–
2-й ступінь: НСО3–+ НОН Н2СО3 + ОН–,
причому гідроліз відбувається в основному за першим ступенем.
3. Солі, утворені слабкими основами і сильними кислотами, гідролізуються за катіоном, оскільки катіон утворює з гідроксид-йонами слабку основу. Середовище розчину в цьому випадку є кислим (рН < 7).
NH4Cl NH4+ + Cl–
NH4+ + 2HOH NH3•Н2О + H3О+
Солі такого типу, але утворені багатокислотними основами, гідролізуються ступінчасто, наприклад:
ZnCl2 Zn2+ + 2Cl–
у водному розчині Zn2+
Zn2+ +4HOH [Zn(Н2О)4]2+
1-й ступінь: [Zn(Н2О)4]2+ + HOH [Zn(Н2О)3(ОН)]+ + H3О+
2-й ступінь: [Zn(Н2О)3(ОН)]+ + НОН [Zn(Н2О)2(ОН)2] + H3О+
причому гідроліз відбувається в основному за першим ступенем.
4. Солі, утворені слабкими основами і слабкими кислотами, гідролізуються і за катіоном і за аніоном, наприклад:
NH4CN NH4+ + CN–
гідроліз за катіоном: NH4+ + 2HOH NH3•Н2О + H3О+
гідроліз за аніоном: CN–+ HOH HCN + OH–
сумарна реакція гідролізу: H3О+ + OH– 2Н2О
В даному випадку рН середовища залежить від сили слабких кислот, що утворюються, і основ (зазвичай рН дорівнює 6 – 8). Такі солі гідролізуються в більшій мірі, ніж розглянуті в п.п. 2 і 3. Гідроліз таких солей відбувається практично безповоротно, якщо виділяється газ або осад або якщо те і інше утворюється одночасно, наприклад:
Al2S3 + 3H2O = 2Al(OH)3↓ + 3H2S↑
