
- •II. Составление уравнения реакции с помощью ионно-электронных уравнений.
- •Блок-схема составления ионно-электронных уравнений
- •Важнейшие окислители и продукты их восстановления
- •Важнейшие восстановители и продукты их окисления
- •Стандартные потенциалы металлов в водном растворе при 298 к.
- •Эквиваленты в овр.
Правила определения степеней окисления.
1.
В простых веществах степени окисления
равны нулю, например Сu0,
 .
.
2. Некоторые элементы в сложных веществах имеют, как правило, постоянные степени окисления, в частности:
а) степени окисления элементов IA-группы, II группы (кроме Hg) и III группы (кроме B и Tl) Периодической системы равны номерам групп со знаком «+», например K+1NO3 (K – элемент IA-группы), Zn+2SO4 (Zn – элемент II группы), Sc+3F3 (Sc – элемент III группы);
б)
степень окисления H
равна +1, кроме соединений с элементами,
перечисленными в пункте а), а также с B
и с Si,
в которых степень окисления водорода
составляет –1, например H+1Br,
но
 ;
;
в)
степень окисления O
равна –2, кроме пероксидов, надпероксидов,
озонидов и фторидов кислорода, например
CCl2O−2,
но
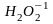 (пероксид водорода),
(пероксид водорода),
 (надпероксид
калия),
(надпероксид
калия),
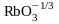 (озонид рубидия),
(озонид рубидия),
 (дифторид
дикислорода);
(дифторид
дикислорода);
г)
степень окисления F
всегда равна –1, например
 ;
;
д)
степени окисления остальных (кроме
фтора) элементов VIIA-группы
Периодической системы обычно равны –1,
кроме соединений с F,
N,
O
и между собой, например
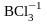 ,
но
,
но
 ;
;
3.
Степени окисления элементов кислотных
остатков в солях такие же, как в кислотах,
образующих эти соли, например в сульфатах
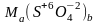 степени окисления S
и O
такие же, как и в серной кислоте
степени окисления S
и O
такие же, как и в серной кислоте
 .
.
4.
Сумма степеней окисления всех атомов
в молекуле (или в формульной единице
вещества немолекулярного строения)
равна нулю, а в ионе – заряду этого иона.
Т. о., для формульной единицы

a·x + b·y + c·z = ±ν,
где A, B, C – символы элементов; a, b, c – степени окисления; x, y, z – стехиометрические индексы в формулах; ν± − заряд (равен нулю для молекулы или формульной единицы вещества немолекулярного строения).
Пример задания:
Номер варианта |
Схемы реакций для заданий |
|
I |
II |
|
пример |
As + HClO + H2O → H3AsO4 + HCl |
CH3CHO + K2Cr2O7 + H2SO4 → CH3COOH + ... + … + … |
I. а) Составление уравнения методом электронного баланса (Ox – окислитель; Red – восстановитель).
ПРИМЕР |
||||||||
As Электронные уравнения полуреакций:
Молекулярное уравнение ОВР: 2 As + 5 HClO + 3 H2O = 2 H3AsO4 + 5 HCl |
б) Определение того, какие вещества являются окислителями, а какие – восстановителями, и за счет каких атомов
ОБЩИЙ ВИД |
ПРИМЕР |
|
Вещество (реагент), содержащее атомы, степени окисления которых в ходе реакции… |
уменьшаются, называется окисли- телем за счет этих атомов |
Вещество HClO является окислителем за счет атомов Cl+1 |
увеличиваются, называется восста- новителем за счет этих атомов |
Вещество As является восстанови- телем за счет атомов As0 |
|
в) Определение типа реакции
ОБЩИЙ ВИД |
ПРИМЕРЫ |
|||
Характер реакции |
Тип ОВР |
|||
Окислитель и восстановитель – это… |
разные вещества |
межмолекулярная |
2 As + 5 HClO + 3 H2O = 2 H3AsO4 + 5 HCl (Ox – HClO за счет Cl+1, Red – As за счет As0) |
|
одно вещество за счет разных атомов |
внутримолекулярная
|
(Ox – HgO за счет Hg2+, Red – HgO за счет O–2) |
||
одно вещество за счет одинаковых атомов |
диспропорционирования |
(и Ox и Red – N2O4 за счет N+4) |
||
Существуют ОВР, которые могут быть отнесены одновременно к разным типам, например, реакция, протекающая по уравнению
 ,
,
сочетает в себе внутримолекулярную реакцию (хлорноватая кислота HClO3 является окислителем за счет атомов Cl+5 и восстановителем за счет атомов O−2) и реакцию диспропорционирования (хлорноватая кислота HClO3 является и окислителем, и восстановителем за счет одинаковых атомов Cl+5).
II. Составление уравнения реакции с помощью ионно-электронных уравнений.
1. Находим среди реагентов вещества-восстановители и вещества-окислители. Определяем частицы-восстановители и частицы–продукты окисления, частицы-окислители и частицы–продукты восстановления (обе частицы должны содержать атомы одного и того же элемента, но с разными степенями окисления). Для всего этого используются таблицы «Важнейшие окислители и продукты их восстановления», «Важнейшие восстановители и продукты их окисления», либо анализ приведенной в задании схемы реакции. Составляем схемы полуреакций
CH3CHO → CH3COOH
Cr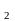 O
O →
Cr3+.
→
Cr3+.
2. Уравниваем схемы (если надо) по атомам, изменяющим свои степени окисления
Cr O → 2 Cr3+.
3. Сравниваем числа атомов O−2 в правой и левой частях полученных схем, уточняем рН среды и, используя нижеприведенную блок-схему, добавляем в обе части схемы формулы Н+, ОH−, или Н2О (если числа атомов O−2 одинаковы в обеих частях схемы, то добавлять формулы Н+, ОH−, или Н2О не надо).
Блок-схема составления ионно-электронных уравнений
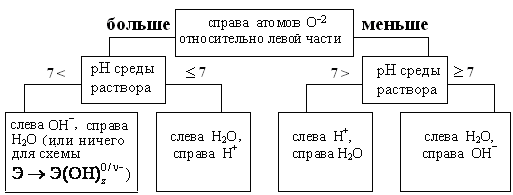
CH3CHO + H2O → CH3COOH + H+
Cr O + H+ → 2 Cr3+ + H2O.
4. Уравниваем полученные схемы по кислороду, по водороду и по зарядам, прибавляя или отнимая слева электроны. Получаем ионно-электронные уравнения полуреакций:
CH3CHO + H2O – 2 е− = CH3COOH + 2 H+
Cr O + 14 H+ + 6 е− = 2 Cr3+ + 7 H2O.
5. Ставим множители к каждому из этих уравнений, равные числу электронов в другом уравнении. Сокращаем (если необходимо) эти множители. Умножаем уравнения полуреакций на полученные множители и складываем полученные произведения между собой. Приводим подобные. Добавляем к обеим частям кратких ионных уравнений формулы ионов, входящих в состав реагентов, но не участвующих в полуреакциях, в таких количествах, чтобы суммарные заряды обеих частей были нулевыми.
+
|
CH3CHO + H2O – 2 е− = CH3COOH + 2 H+ |
|
Cr O + 14 H+ + 6 е− = 2 Cr3+ + 7 H2O |
|
|
|
3
CH3CHO
+ + 8 H+ + 4 H2O |
|
|
+
2 K+
+ 4 SO |
|
6. Объединяем формулы катионов с формулами анионов в формулы веществ. Получаем молекулярное уравнение ОВР.
3 CH3CHO + K2Cr2O7 + 4 H2SO4 = 3 CH3COOH + K2SO4 + Cr2(SO4)3 + 4 H2O.
Важнейшие окислители и продукты их восстановления
Вещества- окислители |
Г2 (Г = Вr, Cl, F, I) |
О2 |
HNO3 |
Н2O |
HCl, H2SO4(разб.) |
|||||
(разб.) |
(конц.) |
|||||||||
Частицы- окислители |
Г2 |
О2 |
|
Н2O |
H+ |
|||||
Частицы – продукты восстановления |
Г− |
ОН− (при рН 7) |
Н2О (при рН < 7) |
NO |
NО2 |
H2 |
||||
Вещества- окислители |
H2SO4(конц.)
|
K2Cr2О7 |
K2CrО4 |
Cоли железа(III) |
РbO2 |
|||||
Частицы- окислители |
|
|
|
Fe3+ (если соль растворима) |
РbO2 |
|||||
Частицы- продукты восстановления |
SО2 |
Cr3+ (при рН < 7); [Cr(OH)6]3− (при рН > 7) |
Fe2+ (если соль растворима) |
Рb2+ (при рН < 7); [Рb(OH)4]2− (при рН > 7) |
||||||
Вещества- окислители |
КГО3 |
NaГO |
MnO2 |
КМnО4 |
||||||
Г ≠ F |
||||||||||
Частицы- окислители |
|
ГО− |
MnO2 |
|
||||||
Частицы- продукты восстановления |
Г− (чаще) или Г2 |
Мn2+ (при рН < 7) |
MnO2 (если 7 ≤ рН <12) |
рН >12) |
||||||

 + H
+ H Cl
O
Cl
O + H
+ H O
→ H
As
O
→ H
As O
O + H
Cl
+ H
Cl


 =
2 K+
+
SO
+
3 SO
.
=
2 K+
+
SO
+
3 SO
.
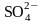




 (при
(при