
- •Міністерство аграрної політики Борщівський агротехнічний коледж
- •Робочий зошит для виконання практичних робіт з дисципліни „Газифіковані котельні агрегати”
- •Практичне заняття № 1
- •5. Практичне заняття № 5 (Реферат) 19
- •Практичне заняття №1
- •Матеріально-технічне забезпечення
- •Теоретичне обгрунтування
- •Послідовність виконання роботи
- •Практичне заняття №2
- •Матеріально-технічне забезпечення
- •Послідовність виконання роботи
- •Практичне заняття №3
- •Матеріально-технічне забезпечення
- •Теоретичне обґрунтування
- •Послідовність виконання роботи
- •Практичне заняття №4
- •Матеріально-технічне забезпечення:
- •Теоретичне обґрунтування:
- •Послідовність виконання роботи
- •Послідовність виконання роботи
- •Практичне заняття №7
- •Матеріально-технічне забезпечення:
- •Теоретичне обґрунтування:
- •Послідовність виконання роботи
- •Практичне заняття №8
- •Матеріально-технічне забезпечення:
- •Теоретичне обґрунтування:
- •Послідовність виконання роботи
- •Література
Послідовність виконання роботи
Задача 1. Перетворити одиниці виміру ρ:
___кгс/см2 = _____атм = _____мм. вод. ст.=______ мм. рт. ст.=______ мПа
Задача 2.
І спосіб
1. Визначаємо кількість тепла за формулою:
![]()
 ,
кДж
,
кДж
![]() =______,
кДж
=______,
кДж
де М - вага повітря, кг.
g - кількість тепла;
Срm - масова теплоємність, кДж/кг·град.
2. Кількість повітря знаходимо з рівняння стану газової суміші:
![]() ,
кг
,
кг
де Р - абсолютний тиск, Па:
Рабс. = Р ат. + Р надл., Па
Рабс. = ______ + ______=______, Па
V - об'єм повітря, м3/кг;
R - газова постійна, Дж/кг · К;
Т - початкова температура повітря, К.
=
![]() =_______,
кг
=_______,
кг
3. По таблицях теплоємності знаходимо масову теплоємність для повітря.

II спосіб
4. Для визначення кількості тепла використовуємо ту саму формулу тільки замість масової теплоємності використовуємо об'ємну теплоємність.
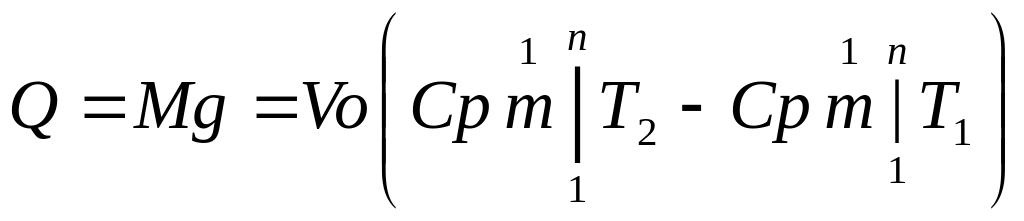 ,
кДж
,
кДж
![]() =_____,
кДж
=_____,
кДж
5. По таблицях теплоємностей знаходимо об'ємну теплоємність:

6. Об'єм повітря приведений до нормальних умов:
![]() ;
м3
;
м3
![]() м3
м3
Висновок: ______________________________________________________
_______________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Контрольні запитання для захисту практичного заняття:
1. Дати визначення робочого тіла.
2. Що називається теплоємністю? Які види теплоємності ви знаєте?
3. Назвати основні параметри робочого тіла.
4. Назвати основні закони ідеальних газів.
__________________________________________
Практичне заняття №2
Предмет Газові котельні агрегати
Тема: Основні приватні випадки термодинамічних процесів: ізохорний, ізобарний, ізотермічний, адіабатний, політропний процеси. Співвідношення між ними.
Мета; Навчитися проводити розрахунки зміни внутрішньої енергії, визначати роботу того чи іншого термодинамічного процесу. Графічно зображати процес.
Матеріально-технічне забезпечення
1. Довідкова література.
2. Обчислювальна техніка.
Після виконання практичного заняття студент повинен
знати: основні приватні випадки термодинамічних процесів;
вміти: вміти правильно провести теплотехнічні розрахунки.
Теоретичне обґрунтування
В теплотехніці можуть зустрічатися найрізноманітніші процеси, в яких один із параметрів залишається незмінним. До таких процесів віносяться:
1) процес при постійному об’ємі - ізохорний;
2) процес при постійному тискові – ізобарний;
3) процес при постійній температурі – ізотермічний;
4) процес без теплообміну із навколишнім середовищем – адіабатний;
Крім перерахованих основних процесів, в термодинаміці розглядається група політропних процесів, в яких проходе одночасна зміна параметрів робочого тіла при наявності теплообміну із навколишнім середовищем.
Вихідні дані
1. М, кг азоту розширюється від початкового стану р1, мПа і t1, °С до кінцевого тиску р2, мПа. Визначити кінцеві параметри і роботу газу при ізотермічному, адіабатному і політропному розширенні. Показник політропи n = 1,2 показник адіабати к = 1,4. Графічно зобразити процес в РV - координатах.
Молекулярна маса азоту μ - 28
Таблиця 4. Параметри початкового стану азоту
Варіант |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
Вага, М, кг
|
3
|
4
|
6
|
5
|
8
|
9
|
7
|
2
|
4
|
7
|
Температура газу t1оС, °С
|
200
|
250
|
220
|
240
|
230
|
270
|
260
|
290
|
280
|
300
|
Початковий тиск р, мПа |
1,0
|
1,1
|
1,2
|
1,3
|
1,4
|
1,5
|
1,6
|
1,7
|
1,8
|
1,9
|
Кінцевий тиск р2, мПа
|
0,3
|
0,5
|
0,7
|
0,6
|
0,4
|
0,2
|
0,8
|
0,5
|
0,7
|
0,9
|
Газова постійна R = 8314,31 Дж/кг · град.
