
- •1.Динамическое состояние белков в организме.Катепсины.
- •2.Пищевые белки как источник ак. Переваривание белков.
- •3.Протеиназы жкт.Субстратная специфичность протеиназ.
- •4.Проферменты протеиназ, механизм превращения в ферменты.Биологическое значение.
- •5.Пепсин, роль, методы количественного определения.
- •6.Экзопептидазы.Их роль в переваривании белков.
- •13. Общая схема источников и путей расходования аминокислот (с лекций)
- •15. Специфичность трансаминаз, коферментная функция вит в6
- •16. Особая роль глутамата в р-ях трансаминирования
- •17. Биологическое значение р-ции трансаминирования
- •19) Окислительное дезаминирование аминокислот, химизм, ферменты , биологическое значение
- •21)Непрямое дезаминирование , транс-дезаминирование, химизм, биологическая роль
- •23) Биогенные амины,происхождение,функции
- •Вопрос 32 Недостаточность фолиевой кислоты и витамина в12. Антивитамины фолиевой кислоты. Механизм действия сульфаниламидных препаратов.
- •Вопрос 33. . Обмен фенилаланина и тирозина. Все пути превращения в норме.
- •1 Реакция – тирозинаминотрансфераза
- •Вопрос 34 - Фенилкетонурия, биохимический дефект, проявление болезни, диагностика, лечение.
- •Вопрос 35. Алкаптонурия, альбинизм. Биохимический дефект, проявление болезней.
- •Вопрос 36 Нарушения синтеза дофамина при паркинсонизме.
- •Вопрос 37 Конечные продукты азотистого обмена: соли аммония и мочевина.
- •46. Распад нуклеиновых кислот, нуклеазы пищеварительного тракта и тканей.
- •49. Инозиновая кислота как предшественник пуриновых мононуклеотидов
- •51. Биосинтез пиримидиновых нуклеотидов.
- •52. Регуляция биосинтеза пуриновых и пиримидиновых мононуклеотидов
- •53. Биосинтез дезоксирибонуклеотидов
- •54. Применение ингибиторов синтеза дезоксирибонуклеотидов для лечения злокачественных опухолей.(тут я мало что нашел…)
- •55. Нарушения обмена нуклеотидов: оротацидурия, ксантинурия. (ксантинурия маловато)
- •56. Подагра, причины возникновения. Применение аллопуринола для лечения подагры.
- •58.Биосинтез(репликация) днк,общая характеристика процесса, биологическое значение. Этапы репликации.
- •60. Синтез днк и фазы клеточного деления. Роль циклинов и циклинзависимых протеинкиназ в продвижении клетки по клеточному циклу.
- •61.Повреждение и репарация днк. Днк- репарирующий комплекс, механизм процесса и условия репарации.
- •62. Биосинтез рнк. Особенности процесса транскрипции, этапы рнк- полимеразы, их роль.
- •63. Понятие о мозаичной структуре генов, первичном транскрипте; механизм созревания рнк (посттранскрипционный процессинг).
- •64. Биосинтез белков. Понятие о коллинеарности кода. Этапы процесса.
- •65. Биосинтез белков. Основные компоненты белоксинтезирующей системы. Биосинтез и созревание м-рнк.
- •66. Понятие о биологическом коде, свойства биологического кода. Универсальность биологического кода и процессов биосинтеза белка.
- •67. Транспортная рнк как адаптор аминокислот. Биосинтез аминоацил-т-рнк.
- •68. Субстратная специфичность арс-аз, их роль. Изоакцепторные т-рнк. (часть не нашла)
21)Непрямое дезаминирование , транс-дезаминирование, химизм, биологическая роль
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
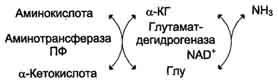
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы (рис. 9-9), что обеспечивает как катаболизм аминокислот (рис. 9-9, А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (рис. 9-9, Б).
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:
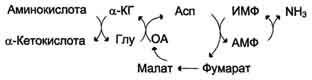
Можно выделить 4 стадии процесса:
-
трансаминирование с α-кетоглутаратом, образование глутамата;
-
трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
-
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
-
гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом (см. схему А на с. 476).
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы (см. схему Б на с. 476).
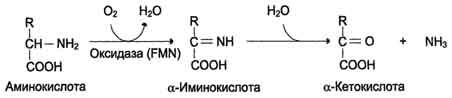
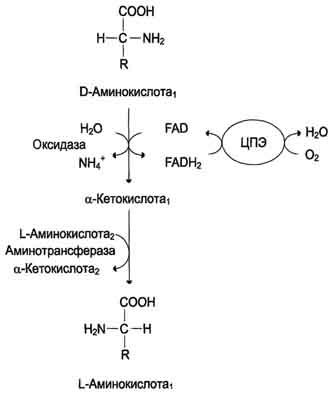
Рис. 9-8. Биологическая роль оксидазы D-аминокислот.
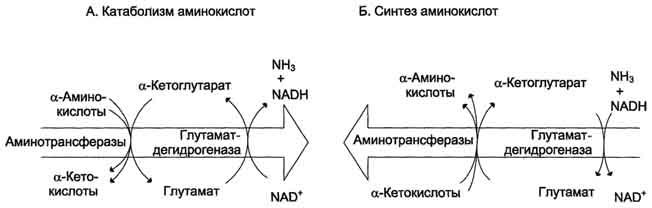
Рис. 9-9. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
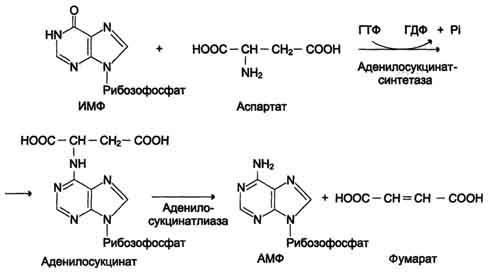
Схема А

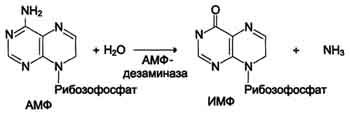
Схема Б.

Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
22)Декарбоксилирование аминокислот.Процесс отщепления карбоксильной группы ак в виде СО2 и приводит к образованию биогенных аминов, которые оказывают фармакологическое действие на физиологические функции человека.
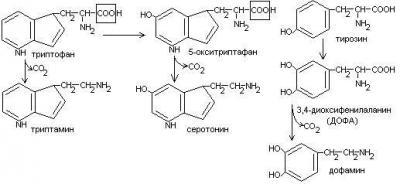
Серотонин обладает сосудосуживающим действием, участвует в регуляции артериального давления, t тела, дыхания, медиатор нервных процессов.
Дофамин- предшественник катехоламинов.
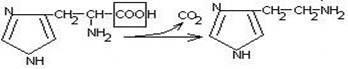
гистидин гистамин
Гистамин обладает сосудорасширяющим действием. Он образуется в области воспаления, участвует в развитии аллергических реакций.
НООС-(СН2)2-СН-СООH →СН2-СН2-СН2-СООН
| |
глутамат NH2 NH2 γ аминомасляная кислота (ГАМК)
ГАМК является тормозным медиатором. В лечебной практике используется при лечении эпилепсии (резкое сокращение частоты припадков).
Орнитин декарбоксилируясь дает диамин – путресцин, а лизин – кадаверин.
СН2-СН2-СН2-СН-СООН →СН2-СН2-СН2-СН2-NH2;
| | |
NH2 NH2 NH2
CH2-CH2-CH2-CH2-CH-COOH → СН2-СН2-СН2-СН2-CH2-NH2
| | |
NH2 NH2 NH2
