
- •Содержание
- •IV.Молярная концентрация эквивалента 21
- •Вещество в растворе • • • •••• колба • • • • • объемом а) • • • 1 литр
- •Процентная концентрация (массовая доля вещества в растворе)
- •Задачи для самостоятельного решения
- •Молярная концентрация
- •Молярная концентрация эквивалента
- •IV. Молярная концентрация эквивалента. (с1/z).
- •V. Закон эквивалентов
- •Задачи для самостоятельного решения по всей теме
- •Приложение Расчет фактора эквивалентности по уравнению реакции через коэффициент стехиометричности
- •Литература
IV. Молярная концентрация эквивалента. (с1/z).
Вспомним формулы обычной молярной концентрации:
ν
С =-
V
Из формулы видно, что концентрация прямо пропорциональна количеству вещества и показывает количества вещества (в моль), содержащихся в единице объема. Понятно, что дробленых мелких частиц будет еще больше в этом же объеме. И связь С1/z и С , будет такая же, как и количества вещества:
С1/Z (Х) = Z · С (Х)
Вывод: для одной и той же массы вещества или объема вещества молярная концентрация эквивалента (эквивалентных частиц) больше, чем молярная концентрация в Z раз.
С - молярная концентрация – это число моль-эквивалентов вещества (количество вещества эквивалентв), содержащихся (содержащегося) в 1 л или 1 дм3 раствора.
22


 ν1/Z
(Х)
m
ν1/Z
(Х)
m
С
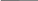 1/Z
(Х)
=- C1/Z
(Х)
=
m
= C1/Z
(Х)
· M1/Z
(Х)
· V
1/Z
(Х)
=- C1/Z
(Х)
=
m
= C1/Z
(Х)
· M1/Z
(Х)
· V
V M1/Z (Х) ·V
Математически: это частное от деления количества вещества, содержащегося в системе к объему системы.
Задача16: В растворе объемом 7 литров содержится KMnO4 31,6 г. Рассчитать молярную концентрацию раствора и молярную концентрацию эквивалента.
Д ано:
Решение:
ано:
Решение:
1) Находим молярную концентрацию р-ра
V р-ра = 7л m 31,6 г
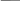
 m(KMnO4)
=31,6 г C
=- = =
m(KMnO4)
=31,6 г C
=- = =
М(KMnO4) = 158г/моль M V 158 г/моль . 7 л
Z= 5
= 0,0286 моль/л
2) Находим молярную концентрацию эквивалента:
С 1/Z = Z . C = 0.0286моль/л ·5 = 0,143 моль\л
C(KMnO4)= ? Ответ: C(KMnO4) = 0,0286 моль/л
С1/Z(KMnO4) = ? . С1/Z(KMnO4) = 0.143 моль/л
Задача 17: В растворе объемом 5 л содержится серная кислота массой 98 г, молярная масса 98 г/моль Вычислить молярную концентрацию и молярную концентрацию эквивалента.
Д ано: Решение:
ано: Решение:
1 способ:
V р-ра = 5л m 98 г
m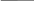
 (H2SO4)
= 98 г 1) С
= = =0,2 моль/л
(H2SO4)
= 98 г 1) С
= = =0,2 моль/л
M = 98 г\моль M V 98г/моль·5 л Z = 2
 2) С1/Z
=С · Z
= 0,2 моль\л. 2 = 0,4 моль /л
2) С1/Z
=С · Z
= 0,2 моль\л. 2 = 0,4 моль /л
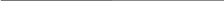
С -? C1\Z --? Ответ: C = 0,2 моль/л; С1/z = 0,4 моль /л
23
2 способ: найдем сначала С1/z. Для этого найдем М1/z , так как

m
C1/Z =
M1/Z ·V
М 98 г/моль
M 1/z = = = 49 г/моль
Z 2
Тогда
98г/моль
C 1/Z = = 0, 4 моль/л
49 г/моль· 5 л
С1/z 0,4 моль/л
 С
= = = 0.2 моль/л
С
= = = 0.2 моль/л
Z 2
Задача18: Рассчитать массу карбоната натрия для приготовления раствора объемом 50 мл с молярной концентрацией эквивалента 0,15 моль/л.
Д ано: Решение:
ано: Решение:
mx
 Vр-ра
= 50 мл C1/z
=
mx
= C1/z.
M1/z
.V
=
Vр-ра
= 50 мл C1/z
=
mx
= C1/z.
M1/z
.V
=
С1/z =0,15моль\л M1/z · V
M (Na2CO3) =106 г/моль Mx
Z =2 = C1/z. · --------- . V =
m (Na2CO3) - ? Zx
106 г\моль
 =
0.15
моль/л ·
· 0,05
л = 3,3975г
=
0.15
моль/л ·
· 0,05
л = 3,3975г
2
Массу обычно рассчитывают до 4-го знака после запятой.
Задача 19: Какой объем хлороводородной кислоты с массовой долей 38 % и плотностью 1,19 г\мл надо взять для приготовления раствора объемом 500 мл и молярной концентрацией эквивалента 2 моль\л
24
Для решения задачи разберем условие и увидим, что речь идет о двух растворах. Берут раствор кислоты с процентной концентрацией (массовой долей), неизвестного в задаче объема и из этого раствора готовят раствор с молярной концентрацией эквивалента. В задаче не говорят, как готовят раствор: добавлением воды или выпариванием определенного количества воды. Да нас это и не должно волновать. Главное мы должны увидеть, что связкой между растворами является неизменная масса чистого вещества хлороводорода. Массу чистого вещества хлороводорода можно вычислить из данных того раствора, которых достаточно для подстановки в формулу.
Для записи условия необходимо правильно и четко поставить индексы 1 и 2 для каждого из двух растворов
Дано: Решение
ZHCl= 1
ρ ( HCl) р-ра1 =1,19 г/мл
W, % (HCl)1 = 38 % 1) Найдем массу HCl чист., содержащегося в
V ( HCl) р-ра2 = 500 мл 500 мл раствора HCl c молярной конц.
С1\Z( HCl) р-ра2 = 2 моль/л эквивалента 2 моль/л, так как для этого
М HCl = 36,5 г/моль есть все данные
 V
р-ра 1
--?
V
р-ра 1
--?
m2 чист. HCl = C 1\Z(HCl) · M1/z( HCl) · V(HCl) =
2 моль/л ·36,5г/моль · 0,5 л = 36,5 г
m1 чист. HCl = m2 чист. HCl = 36,5 г
) Рассчитаем, какова масса 38 % 1р-ра HCl, если масса HСlчист = 36,5г
mHClчист · 100% 36,5 г ·100%
m
 1
p-pa
HCl
=
=
= 96,05г
1
p-pa
HCl
=
=
= 96,05г
w% HCl 38 %
Найдем объем 38%-го раствора HCl c массой 96,05 г
m 1 p-pa HCl 96,05 г
V
 р-ра
1 = = = 80,71 мл
р-ра
1 = = = 80,71 мл
𝛒1 p-pa HCl 1,19 г/мл
Выводы и указания для решения такого типа задач:
Помните что в формуле с использованием молярной концентрации или молярной концентрации эквивалента подразумевается объем с использованием размерности – литр [л]
25
В формуле перевода массы раствора в объем раствора через плотность используется размерность г/мл и в результате объем получаем в миллилитрах [мл].
Порядок логических рассуждений и прием запоминания:
а) Неизвестное ищем для раствора с W (массовой долей), поэтому сначала работаем с концентрацией «С1/z»; (ищем массу чистого вещества)
б) Затем работаем с формулой, включающей W (ищем массу необходимого раствора)
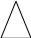 в)
Переводим массу раствора в плотность
по формуле с использованием «треугольника»:
в)
Переводим массу раствора в плотность
по формуле с использованием «треугольника»:
m
 ρ·V
ρ·V
Итак,
- буква «С» находится по алфавиту раньше, чем W – работаем с формулой
mx
C1/z = mx = C1/z. M1/z .V =
M1/z · V
- буква «W» находится в алфавите после «С» и затем работаем с ней;
- работаем с «треугольником».
Всего выполняем 3 действия в такой задаче. Однако, если необходимо, то переводим М в М1/z
