
- •Содержание
- •IV.Молярная концентрация эквивалента 21
- •Вещество в растворе • • • •••• колба • • • • • объемом а) • • • 1 литр
- •Процентная концентрация (массовая доля вещества в растворе)
- •Задачи для самостоятельного решения
- •Молярная концентрация
- •Молярная концентрация эквивалента
- •IV. Молярная концентрация эквивалента. (с1/z).
- •V. Закон эквивалентов
- •Задачи для самостоятельного решения по всей теме
- •Приложение Расчет фактора эквивалентности по уравнению реакции через коэффициент стехиометричности
- •Литература
Молярная концентрация эквивалента
I. Эквивалент – это условная или реальная частица, которая в данной химической реакции эквивалентна одному атому или иону водорода, или одному протону, или одному электрону (по - другому, способна замещать или присоединять 1 грамм водорода).
Эквивалент – есть 1/z часть частицы (молекулы, атома).
18
Если Z =1 (1 /1=1) , то эквивалент идентичен самой частице (реальной частице – атому или молекуле) Z - это число эквивалентности или число эквивалентов.
Если Z = 2,3,4 и т.д., то эквивалент идентичен какой-то части молекулы или атома (условная частица - 1/ z*).
У окислителей и восстановителей Z* будет равно числу принятых или отданных электронов. Например, для процесса: Mn+7 +5e Mn +2 Z* = 5. От молекулы КMnO4 только 1/5 часть будет эквивалентной одному электрону.
Обратная величина числу эквивалентов (Z) – это фактор эквивалентности – f. Он и показывает, какая часть от реальной частицы эквивалентна иону или атому водорода, или одному электрону (в ОВР).

f = 1/z
Он принимает дробные значения: 1/2, 1/3, 1/4 и т.д.
Для оснований и амфотерных гидроксидов в форме оснований число эквивалентов Z равно числу гидроксид- анионов. Например, Z (KOH) = 1;
Z* (Са(OH)2) = 2 (без учета протекания реакций или до средних или до основных солей)
Для кислот Z равно числу атомов водорода, то есть, основности кислоты. Например, Z (HCl) = 1. Z (H3PO4 )= 3
У солей Z равно произведению валентности (степени окисления) металла на число атомов металла. Например, Z (CaCl2) = (+2) · 1 = 2; Z (Al2(SO4)3) = 3·2 = 6.
У окислителей и восстановителей Z будет равно числу принятых или отданных электронов.
Например, а) MnO4 - Mn2+ ;
Mn+7 +5e Mn2;
Z (KMnO4) = 5; f = 1/5
б) I2 + 2 e 2 I- (I2 2KI)
Z (I2 ) = 2; f = ½
и наоборот :
в) 2I- -2 e I2
Z (KI ) = 1; f = 1 , так как на 2 иона I- приходится 2 электрона, а на один ион I-1 придется 1 электрон.
19
Рассмотрим значения Z и f для многоосновных кислот и многокислотных оснований не в процессе окислительно-восстановительных реакций, а в процессе протекания реакций обмена:
1) 2NaOH + H2SO4 = Na2SO4 + 2H2O
2 моль 1 моль
В 1 моль NaOH содержится 1 моль ОН- , а ему соответствует в воде 1 моль Н+, так как молекулу воды можно представить Н ОН, то есть на 1 грамм
водорода приходится 1 моль ОН. Рассмотрим данное уравнение. В нем участвует 2 моль щелочи, а, значит, в моль ОН. На 2 моль ОН здесь приходится 1 моль Н2SO4, в котором содержится 2 моль Н. Таким образом на 1 моль NaOH , а, значит, и на 1 моль ОН и на 1 моль Н приходится 0,5 моль Н2SO4. Таким образом, f (Н2SO4,) = ½ в данном уравнении. Заметим, что по рассуждениям соответствия NaOH и H OH f (NaOH) всегда будет равен 1 (как и KOH, HCl, LiOH, HNO3, т.е. однокислотных оснований и одноосновных кислот). В аналитической химии говорят, что растворы KOH, HCl, LiOH, HNO3, NaOH готовят с учетом реальных частиц (Z = 1 и f =1), т.е. 1 моль (или одной молекулы), а не какой – то части.
Рассмотрим другой случай:
2) NaOH + H2SO4 = NaНSO4 + H2O
1 моль 1 моль
Рассуждаем так: на 1 моль щелочи приходится в этой реакции 1 моль серной кислоты, т.е. , на 1 ОН группу приходится 1 молекула Н2SO4. Значит, Z и f = 1.
Расчет фактора эквивалентности в уравнениях реакций через коэффициент стехиометричности смотри в приложении .
II. Величины более мелких частиц («дробленых»), выраженные как количество вещества называются количеством вещества эквивалента

ν1/Z (Х) = Z · ν (Х)
где: ν – обычное количество вещества Х
Z – число эквивалентов вещества Х
ν1/Z (Х) – количество вещества эквивалентов для вещества (Х)
Дано 6 моль серной кислоты: 6 H2SO4 (это обычное количество вещества.) При Z =2 и f = ½ в каждом моль кислоты содержится уже 2 дробленых
частицы, т.е., количества вещества эквивалентных частиц = 2. В 6 моль эквивалентных будет 12, в 2 раза больше.
20
ν1/Z (H2SO4 ) = Z· ν (H2SO4) = 2 · 6 = 12.
Вывод: количество вещества эквивалента всегда больше обычного количества вещества в Z раз.
III. Молярная масса эквивалента. (M1/z).
Из данных формул видно, что вместо обычной молярной массы в них входит величина M1/z – молярная масса эквивалента (дробленой части одного моль) и, конечно, она будет меньше молярной массы в Z раз:




М M1/z
M
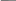 1/z
= или M1/z
= М · f
M
= M1/z
· Z
или M
=
1/z
= или M1/z
= М · f
M
= M1/z
· Z
или M
=
Z f

Например: Если Z (H2SO4 ) = 2 или f= ½; М= 98 г/моль
Тогда,
М 98 г/моль
M 1/z = = = 49 г/моль
Z 2
Или M1/z = М · f = 98 г/моль · ½ = 49 г/моль
Этот расчет можно оформить в виде задачи:
Задача 13: Рассчитать молярную массу эквивалента H2SO4:
Д ано: Решение:
ано: Решение:
Mх = 98 г/моль Mx 98
M 1/Z = ------------- = ----------- = 49 г/моль
Zx 2
Z = 2
V 1/Z = ? Ответ: молярная масса эквивалента (H2SO4) = 49г/моль
21
Задача 14: Рассчитать количество вещества эквивалента для 2-х моль KMnO4
(в задачах про перманганат калия будем считать, что протекает ОВ процесс с переходом 5 электронов: MnO4 - Mn2+ ; Mn+7 +5e Mn2;)

Дано: Решение:
ν (KMnO4) = 2 моль ν 1/Z = Z ·ν = 5 ·2 моль = 10 моль (-экв)
Z= 5
ν 1/Z = ? Ответ: кол-во вещества эквивалента (KMnO4 ) = 10 моль
Mx
в) Молярная масса эквивалента: M 1/Z* = ------------- (г/моль, кг/ моль)
Z*x
