
- •Содержание
- •IV.Молярная концентрация эквивалента 21
- •Вещество в растворе • • • •••• колба • • • • • объемом а) • • • 1 литр
- •Процентная концентрация (массовая доля вещества в растворе)
- •Задачи для самостоятельного решения
- •Молярная концентрация
- •Молярная концентрация эквивалента
- •IV. Молярная концентрация эквивалента. (с1/z).
- •V. Закон эквивалентов
- •Задачи для самостоятельного решения по всей теме
- •Приложение Расчет фактора эквивалентности по уравнению реакции через коэффициент стехиометричности
- •Литература
Задачи для самостоятельного решения
Вычислить массовую долю соли в растворе. Масса раствора 320 г. Масса щелочи 16 г.
45 г соли растворили в 135 г воды. Вычислить массовую долю соли в растворе.
Вычислить массу вещества аммиака, если известно, что объем раствора составляет 1,5 л, плотность раствора 1,056 г/мл, а массовая доля аммиака равна 10 %.
Вычислить массу спирта в растворе ацетона в спирте, если
известно, что объем раствора составляет 400 мл, плотность раствора составляет 1, 14 г/мл, а массовая доля ацетона равна 20 %.
К раствору массой 510 г с содержанием вещества 35% добавили 100 мл воды. Какова массовая доля полученного раствора?
Из раствора массой 112 г с содержанием вещества 40% вещества выпарили 25 мл воды. Какова массовая доля полученного раствора?
Определить массу углекислого газа, если в реакцию с соляной кислотой вступило 200 мл 10 %-го раствора карбоната натрия; ρ (р-ра Na2CO3) = 1, 19 г/мл.
Смешали 300 мл раствора (ρ = 1,23 г/мл) с массовой долей вещества 10% и 0,065 л раствора с массовой долей того же вещества 12 %. Определить массовую долю вещества (в %) в полученном растворе.
Молярная концентрация
Важная величина при расчете всех концентраций – количество вещества (моль)
Количество
вещества : ν =![]() [ г/моль]
[ г/моль]
Количество вещества обозначается ν (ню), выражается в моль
Молярная масса (М): г/моль; кг/ моль; кг/ кмоль. Чаще пользуются размерностью г/моль
16
m
M =- ---------- ; m = M .ν
ν
Задача 10: Вычислить массу серной кислоты количеством вещества 3 моль.
Д ано: Решение:
ано: Решение:
m = M . v = 98 г / моль . 3 моль = 294 г
v = 3 моль
М (H2SO4) = 98 %
m (H2SO4) -? Ответ: масса трех моль кислоты составляет
294 г.
Молярная концентрация растворов (С):

С - молярная концентрация – это число молей вещества (количество вещества), содержащихся (содержащегося) в 1 л или 1 дм3 раствора.



ν m
С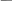
 = C
=
m
= C·
M
· V
= C
=
m
= C·
M
· V
V M ·V
Математически: это частное от деления количества вещества, содержащегося в системе к объему системы.
Например, С = 0,1 моль/дм3 (моль/л)
Обычно, расчет молярной концентрации проводят до третьего знака после запятой (третья значащая цифра после запятой) с округлением:
получилось 1,3462 - оставляем 1,346 моль/л
получилось 0, 2537 – оставляем 0, 254моль/л
или до четвертого знака после нулей после запятой:
получилось 0, 01276 – оставить 0,0128 моль/л
17
Задача 11: В растворе объемом 2 л содержится 12 моль аммиака. Вычислить молярную концентрацию раствора аммиака.
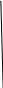
Дано: Решение:
V р-ра = 2 л ν 12 моль
ν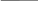
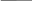 = 12 моль Саммиака
= = = 6 моль /л
= 12 моль Саммиака
= = = 6 моль /л
V 2 л
Саммиака -? Ответ: молярная концентрация равна
6 моль /л
Задача 12: Определить массу бромида бария, необходимого для приготовления 200 мл раствора с молярной концентрацией эквивалента 0,05 моль\л. М (ВaBr2) = 137 г/моль.

Дано: Решение:
V р-ра = 200 мл m = C· M · V
С(ВaBr2) = 0,05 моль /л m = 0,05 моль/л· 137г/моль · 0,2 л =
 = 1,37 г
= 1,37 г
m(ВaBr2) -? Ответ: m(ВaBr2) = 1,37 г
