
- •Предмет и значение курса общей химии. Строение атома
- •Строение атома
- •Квантовая модель
- •Принципы заполнения атомных орбиталей электронами
- •Тема 2 Периодический закон и система элементов д.И.Менделеева
- •Структура периодической системы
- •Тема 3 Химическая связь и строение химических соединений
- •Длина связи – кратчайшее расстояние между ядрами атомов.
- •Метод валентных связей (мвс)
- •Механизм образования ковалентной связи.
- •Типы ковалентной связи
- •Характеристика ковалентной связи
- •Тема 4 Метод молекулярных орбиталей (ммо)
- •Тема № 5 Комплексные соединения
- •Каково строение к.С., как они образуются?
- •Как происходит образование комплексных соединений (к.С.) Для объяснения образования к.С. Используется ряд теорий
- •Устойчивость комплексных соединений
- •Классификация комплексных соединений
- •Тема № 6 Растворы электролитов
- •Механизм образования растворов
- •Растворы сильных электролитов
- •Растворы слабых электролитов
- •Ступенчатый характер ионизации
- •Теории кислот и оснований
- •Теория Льюиса
- •Ионизация воды
- •Таким образом, при
- •Гидролиз солей
- •Растворимость
- •Тема 7 Окислительно – восстановительные реакции
- •Факторы, влияющие на протекание окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций
- •Как составляются уравнения реакций?
- •Составление окислительно-восстановительных реакций ионно-электронным способом
Тема 7 Окислительно – восстановительные реакции
Все реакции можно разделить на 2 группы: реакции, в которых степень окисления атомов остается постоянной и реакции, идущие с изменением степени окисления.
О кислительно–восстановительными
реакциями называют химические
процессы, сопровождающиеся переносом
электронов от одних молекул или ионов
к другим.
кислительно–восстановительными
реакциями называют химические
процессы, сопровождающиеся переносом
электронов от одних молекул или ионов
к другим.
О кислительно–восстановительными реакциями называют химические процессы, протекающие с изменением степени окисления атомов вследствие перераспределения электронов между ними.
В ещества,
атомы или ионы которого отдают электроны,
называются восстановителями.
Вещества, которые присоединяют
электроны, называются окислителями.
ещества,
атомы или ионы которого отдают электроны,
называются восстановителями.
Вещества, которые присоединяют
электроны, называются окислителями.
П роцесс
потери (отдачи) электрона, сопровождающийся
повышением степени окисления, называется
окислением.
роцесс
потери (отдачи) электрона, сопровождающийся
повышением степени окисления, называется
окислением.
Процесс присоединения электрона, сопровождающийся понижением степени окисления, называется восстановлением.
К типичным восстановителям относят:
Простые вещества, атомы которых обладают малой электроотрицательностью (Ме I, II групп). Восстановительная способность тем больше, чем ниже энергия ионизации этих атомов.
Простые анионы Cl-, S-2, а также сложные анионы, в которых электроположительный элемент не имеет максимальной степени окисления
 ;
;
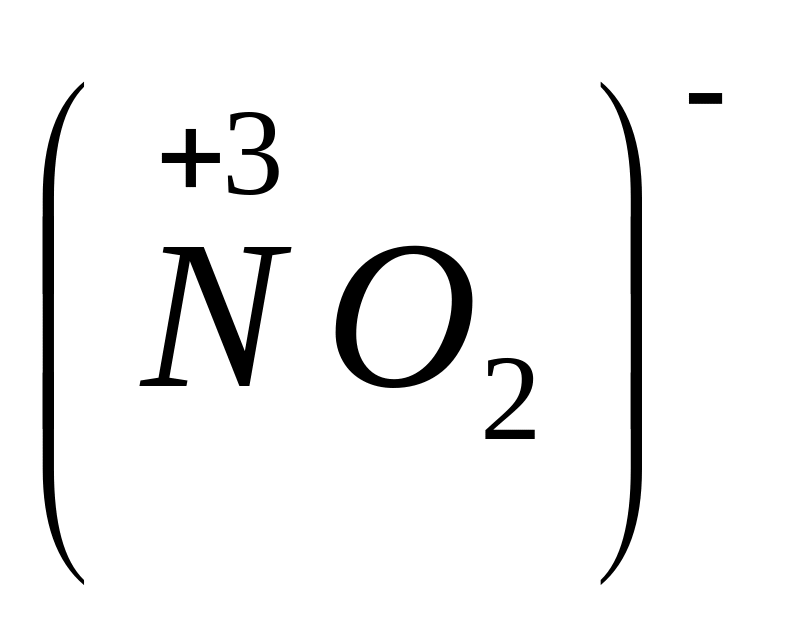 .
.
Катионы, в которых элемент проявляет не максимальную степень окисления и она может возрастать - Sn+2, Fe+2.
Некоторые вещества при повышении температуры С, СО, Н2.
Факторы, влияющие на протекание окислительно-восстановительных реакций
Протекание окислительно-восстановительных реакций зависит от природы взаимодействующих веществ и от условий проведения реакций.
От концентрации реагента
Температуры реакции
Наличия катализатора
Влияние характера среды – окислительно-восстановительные реакции протекают в разных средах.
Направление окислительно-восстановительных реакций
В основе определения направления лежит правило:
О кислительно-восстановительные
реакции самопроизвольно протекают
всегда в сторону превращения сильного
окислителя в слабый сопряженный
восстановитель или сильного восстановителя
в слабый сопряженный окислитель.
кислительно-восстановительные
реакции самопроизвольно протекают
всегда в сторону превращения сильного
окислителя в слабый сопряженный
восстановитель или сильного восстановителя
в слабый сопряженный окислитель.
Кроме окислительно-восстановительных потенциалов для определения направления данных реакций используют ее величину ЭДС.
Э ДС окислительно-восстановительной реакции в стандартных условиях равна разности стандартных потенциалов сопряженных окислительно-восстановительных пар, участвующих в реакции
![]()
Условием протекания реакции является положительное значение ЭДС.
Окислительно-восстановительные реакции можно разделить на
межмолекулярные;
внутримолекулярные;
самоокисления – самовосстановления (диспропорционирования).
Межмолекулярные окислительно-восстановительные реакции протекают с изменением степени окисления атомов в разных молекулах
Внутримолекулярные окислительно-восстановительные реакции идут с изменением степени окисления атомов в разных элементах в одной и той же молекуле. Обычно это реакции термического разложения веществ
Реакции самоокисления – самовосстановления протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Эти реакции характерны для тех веществ, в которых есть атомы с промежуточной степенью окисления.
