
- •Предмет и значение курса общей химии. Строение атома
- •Строение атома
- •Квантовая модель
- •Принципы заполнения атомных орбиталей электронами
- •Тема 2 Периодический закон и система элементов д.И.Менделеева
- •Структура периодической системы
- •Тема 3 Химическая связь и строение химических соединений
- •Длина связи – кратчайшее расстояние между ядрами атомов.
- •Метод валентных связей (мвс)
- •Механизм образования ковалентной связи.
- •Типы ковалентной связи
- •Характеристика ковалентной связи
- •Тема 4 Метод молекулярных орбиталей (ммо)
- •Тема № 5 Комплексные соединения
- •Каково строение к.С., как они образуются?
- •Как происходит образование комплексных соединений (к.С.) Для объяснения образования к.С. Используется ряд теорий
- •Устойчивость комплексных соединений
- •Классификация комплексных соединений
- •Тема № 6 Растворы электролитов
- •Механизм образования растворов
- •Растворы сильных электролитов
- •Растворы слабых электролитов
- •Ступенчатый характер ионизации
- •Теории кислот и оснований
- •Теория Льюиса
- •Ионизация воды
- •Таким образом, при
- •Гидролиз солей
- •Растворимость
- •Тема 7 Окислительно – восстановительные реакции
- •Факторы, влияющие на протекание окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций
- •Как составляются уравнения реакций?
- •Составление окислительно-восстановительных реакций ионно-электронным способом
Механизм образования ковалентной связи.
В методе ВС различают обменный и донорно - акцепторный механизм образования ковалентной связи.
При обменном механизме – химическая связь образуется за счет неспаренных электронов атома.
В результате рассмотренных механизмов образования ковалентной связи можно сделать вывод о том, что максимальная ковалентность атома определяется числом неспаренных электронов и (вакантных орбиталей) неподеленных электронных пар.
Типы ковалентной связи
Различают ковалентную связь: - типа.
- связь образуется при перекрывании электронных орбиталей вдоль оси связи, соединяющей ядра атомов. Она образуется при перекрывании s, p, d – орбиталей.
связь – образуется перекрыванием электронных облаков по линии, перпендикулярной оси связи. Такую связь образуют p и d – орбитали
кратные связи. Например, в молекуле этилена — 1и 1связи; в молекуле азота одна и 2связи.
Кратность ковалентной связи характеризуется числом общих электронных пар между соединенными атомами.
Характеристика ковалентной связи
Насыщенность. Под насыщенностью понимают способность атома образовывать строго определенное количество связей. Она определяется числом неспаренных электронов.
Направленность связей. Направленность связи может быть объяснена направленностью атомных орбиталей в пространстве (все орбитали, кроме s имеют направленность).
Гибридизация – это процесс соединения различного типа, близких по энергии атомных орбиталей с возникновением новых гибридных орбиталей равных по форме и энергии.
Полярность связи. Важное значение для химических свойств молекул имеет распределение заряда в молекулах. В зависимости от распределения заряда различают полярные и неполярные молекулы.
Поляризуемость – это способность электронной плотности связи перемещаться под действием внешнего электрического поля или других воздействий.
Тема 4 Метод молекулярных орбиталей (ммо)
Основные принципы метода МО:
Молекула рассматривается как совокупность ядер и электронов, где каждый электрон движется в поле остальных электронов и всех ядер.
Состояние электрона описывается волновой функцией (
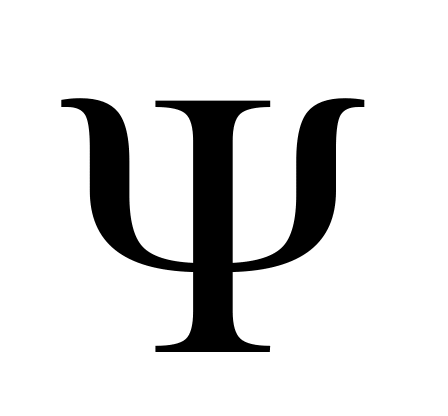 ),
которая характеризуется определенным
набором квантовых чисел. Эта функция
называется молекулярной
орбиталью.
Волновую функцию (
),
определяющую область наиболее вероятного
нахождения и энергетический уровень
электронов в молекуле, называют
молекулярной
орбиталью.
Молекулярная орбиталь в общем случае
многоцентровая. Теория, использующая
представление о молекулярной орбитали
для расчета различных характеристик
молекул, называется методом
молекулярных орбиталей.
),
которая характеризуется определенным
набором квантовых чисел. Эта функция
называется молекулярной
орбиталью.
Волновую функцию (
),
определяющую область наиболее вероятного
нахождения и энергетический уровень
электронов в молекуле, называют
молекулярной
орбиталью.
Молекулярная орбиталь в общем случае
многоцентровая. Теория, использующая
представление о молекулярной орбитали
для расчета различных характеристик
молекул, называется методом
молекулярных орбиталей.Каждой молекулярной орбитали соответствует определенная энергия. Количество МО равно количеству электронов, участвующих в их образовании.
Совокупность молекулярных орбиталей молекулы, занятых электронами называется электронной конфигурацией молекулы. Конфигурация определяется следующими положениями:
принципом наименьшей энергии (электрон занимает орбиталь с меньшей энергией);
принципом Пауле (на одной МО не может быть более двух электронов с антипараллельными спинами);
правилом Хунда.
Порядок заполнения МО
Основной принцип заполнения МО аналогичен принципам заполнения АО.
1). Принцип наименьшей энергии;
2). Правило Хунда;
3). Принцип Паули.
