- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Хлор и его соединения
Свободный хлор Cl2
Физические свойства: Cl2 – газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха.
Химические свойства
Хлор – очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-
Cl2 + 2e → 2Cl-
1. Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Cl2 + 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водяными растворами:
Cl2 + Cu = CuCl2
3Cl2 + 2Au = 2AuCl3
2. Реакции с неметаллами
Хлор непосредственно не взаимодействует только с О2, N2, C. С остальными неметаллами реакции протекают при различных условиях. Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Cl2 + H2 2HCl
Cl2 + 2S(расплав) S2Cl2
3Cl2 + 2P = 2PCl3 (или PCl5 – в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2
+ I2
![]() 2I+3Cl3-1
2I+3Cl3-1
3. Вытеснение свободных неметаллов из их соединений:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
3Cl2 + 2NH3 = N2 + 6HCl
Диспропорционирование хлора в воде и водных растворах щелочей.
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3–.
Cl2 + H2O = HCl + HClO (хлорная вода)
Cl2 + 2KOH = KCl + KClO + H2O (жавелевая вода)
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
3Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O (хлорная известь)
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора: KClO и Ca(ClO)2 – гипохлориты; KClO3 – хлорат калия (бертолетова соль).
Хлороводород и соляная кислота
Газообразный хлороводород: физические и химические свойства
HCl – хлорид водорода. Бесцветный газ с резким запахом. Безводный HCl и в газообразном, и в жидком состояниях неэлектропроводен. Химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный хлороводород реагирует с металлами, причем такими малоактивными, как Cu и Ag.
Восстановительные свойства хлорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при обычной Т, а также при высокой Т в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Cl2 + 2HF
4HCl
+ O2
![]() 2Cl2 +
2H2O
2Cl2 +
2H2O
Газообразный HCl широко используется в органическом синтезе.
Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при обычной Т в 1 л Н2О растворяется около 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37%. Такой раствор имеет очень резкий, удушающий запах. Молекулы HCl в воде практически полностью распадаются на ионы, т.е. водный раствор хлороводорода является сильной кислотой.
Химические свойства
Взаимодействие:
1. с металлами (до Н):
2HCl + Zn = ZnCl2 + H2↑
2. с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + H2O
6HCl + Al2O3 = 2AlCl3 + 3H2O
3. с основаниями и амфотерными гидроксидами:
2HCl + Ca(OH)2 = CaCl2 + 2H2O
3HCl + Al(OH)3 = AlCl3 + 3H2O
4. с солями более слабых кислот:
2HCl + CaCO3 = CaCl2 + CO2↑ + H2O
HCl + C6H5ONa = C6H5OH + NaCl
5. с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями (Анион Cl- окисляется до свободного галогена: 2Cl- - 2e → Cl2↑ ).
Особое значение имеет ОВР между соляной и азотной кислотами:
3HCl + HNO3 = Cl2↑ + NOCl + 2H2O
(“царская водка”)
NOCl = NO + Cl(атомарн.)
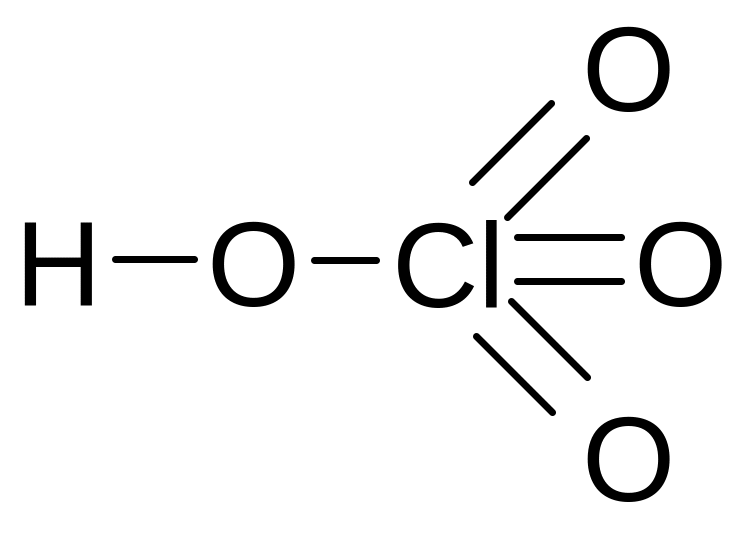
Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора – чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
Кислотные оксиды |
Оксид хлора(I) не выделены как индивидуальные вещества Оксид хлора (VII) |
|||
Кислоты |
хлорноватистая хлористая хлорноватая хлорная
Сила кислот увеличивается (KДИС.) Окисляющее воздействие ослабевает Прочность молекул возрастает |
|||
Названия солей |
гипохлориты |
хлориты |
хлораты |
перхлораты |
Практические важные соли |
NaClO KClO Ca(ClO)2 |
Ca(ClO2)2 |
KClO3 бертолетова соль Mg(ClO3)2 |
KClO4 NaClO4 NH4ClO4 |
Химические свойства
Все оксокислоты хлора и их соли являются сильными окислителями.
Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
2KCl+5O32-
![]() 2KCl1- + 3O20
2KCl1- + 3O20
2NaCl+3O22- 2NaCl1- + 3O20
4KCl+5O3 KCl1- + 3KCl+7O4
Хлорная известь
Хлорная
(белильная) известь – смесь гипохлорита
и хлорида кальция, обладает отбеливающим
и дезинфицирующим действием. Иногда
рассматривается как пример смешанной
соли, имеющей в своем составе одновременно
анионы 2-х кислот:
![]() и Cl-Ca-O-Cl
и Cl-Ca-O-Cl
Жавелевая вода
Водный раствор хлорида и гипохлорита калия (KCl + KClO + H2O)