
- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Тема: р-Элементы VII группы
Ключевые слова: p-элементы, фтор, хлор, бром, иод, «галогены», двухатомные молекулы, типичные неметаллы, водородные связи, галиды,кислородные кислоты хлора, хлорная известь, хлораты, броматы, иодаты, химизм бактерицидного действия, хлорная вода, хлориды, фториды, бромиды, иодиды.
Характеристика элементов
-
9F
1s22s22p5
17Cl
[Ne] 3s23p5
35Br
[Ar] 3d104s24p5
53I
[Kr] 4d105s25p5
85At
[Xe] 4f145d106s26p5
5 элементов главной подгруппы VII группы имеют общее групповое название «Галогены» (Hal), что означает «солерождающие». Одинаковое строение внешнего электронного слоя (ns2np5) обусловливает большое сходство элементов.
Сходство элементов
Типичные неметаллы, р-элементы
Большая величина энергии сродства к ē
Высокие значения электроотрицательности (ЭО)
Стремление к присоединению 1 ē до завершения октета Hal0 + 1ē = Hal-
Устойчивость анионов Hal-
Высокая окислительная активность
Наиболее устойчивая степень окисления атомов в соединениях -1 (валентность I)
З акономерное
вертикальное изменение свойств элементов
акономерное
вертикальное изменение свойств элементов
F Заряд ядра ↑
Cl Число электронных слоев ↑
Br Радиус атома ↑
I Е сродства к ē ↓
At Электроотрицательность ↓
Неметалличность ↓
Простые вещества Hal2
 F2 (газ) Т.
пл. и т. кип. ↑
F2 (газ) Т.
пл. и т. кип. ↑
Cl2 (газ) Растворимость в воде ↓ (к F2 не относится)
Br2 (ж) Прочность связи в молекулах ↓
I2 (тв.) Неметаллические свойства ↓
Окислительная способность ↓
Химическая активность ↓
Валентные состояния атомов Cl, Br, I - ns2np5
nd
np 

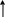
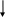





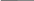
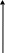
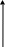
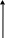
ns
При образовании ковалентных связей галогены чаще всего используют один неспаренный р-электрон, имеющийся в невозбужденном атоме, проявляя при этом В = 1.
Образуя связи с атомами более электроотрицательных элементов, атомы хлора, брома и йода могут переходить из основного валентного состояния в возбужденное, что сопровождается переходом электронов на вакантные орбитали d-подуровня. При этом число неспаренных электронов увеличивается, вследствие чего атомы Cl, Br, I могут образовывать большее число ковалентных связей:
-
Возбужденные состояния
Число неспаренных ē
Валентность
ns2np4nd1
3
III
ns2np3nd2
5
V
ns1np3nd3
7
VII
Отличие F от других галогенов
В атоме фтора валентные электроны находятся на 2-м энергетическом уровне, имеющем только s- и р-подуровень. Это исключает возможность перехода атомов F в возбужденные состояния, поэтому фтор во всех соединениях проявляет постоянную валентность, равную I. Кроме того, фтор – самый электроотрицательный элемент, вследствие чего имеет постоянную с.о. -1.
Важнейшие соединения галогенов
Галогеноводороды HHal
Галогениды металлов (соли галогеноводородных кислот) – самые многочисленные и устойчивые соединения галогенов.
Галогенорганические соединения.
Кислородсодержащие вещества:
- неустойчивые оксиды, из которых достоверным можно считать существование 6 оксидов (Cl2O, ClO2, Cl2O7, Br2O, BrO2, I2O5).
- неустойчивые оксокислоты, из которых только 3 кислоты выделены как индивидуальные вещества (HClO4, HIO3, HIO4).
- соли оксокислот, главным образом хлориты, хлораты и перхлораты.
