
- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Пиросерная кислота
Молекулярная формула - H2S2O7
Графическая формула
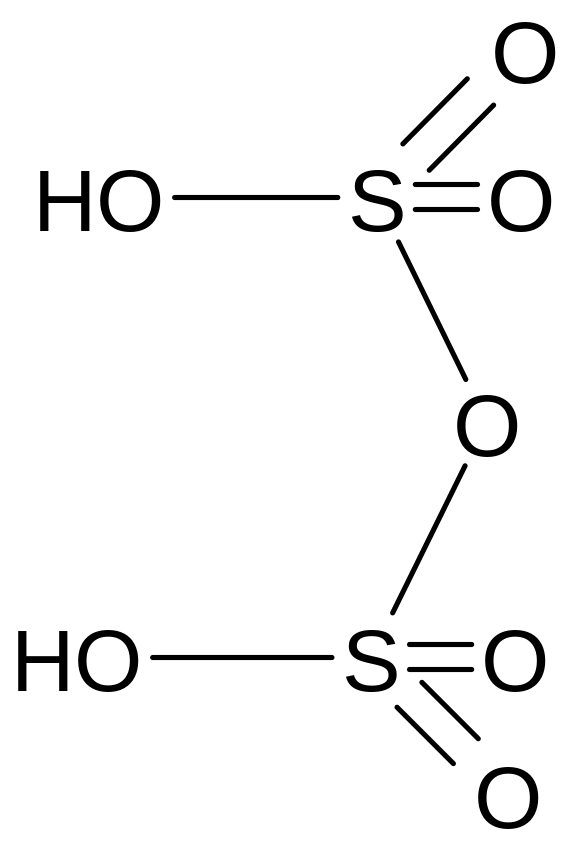
Пиросерная кислота или дисерная кислота (выделяется при охлаждении олеума в виде кристаллов)
Соли дисерной кислоты называются пиросульфатами:
2 KHSO4 K2S2O7 + H2O
Гидросульфат калия
При нагревании гидросульфата калия образуются пиросульфаты (персульфаты).
Cоли и кислота проявляют резко выраженные окислительные свойства.
K2S2O7 = SO3 + K2SO4
Na2S2O7 = Na2SO4 + SO3
Пероксомоносерная кислота (мононадсерная кислота)
Молекулярная формула - H2SO5
Графическая формула
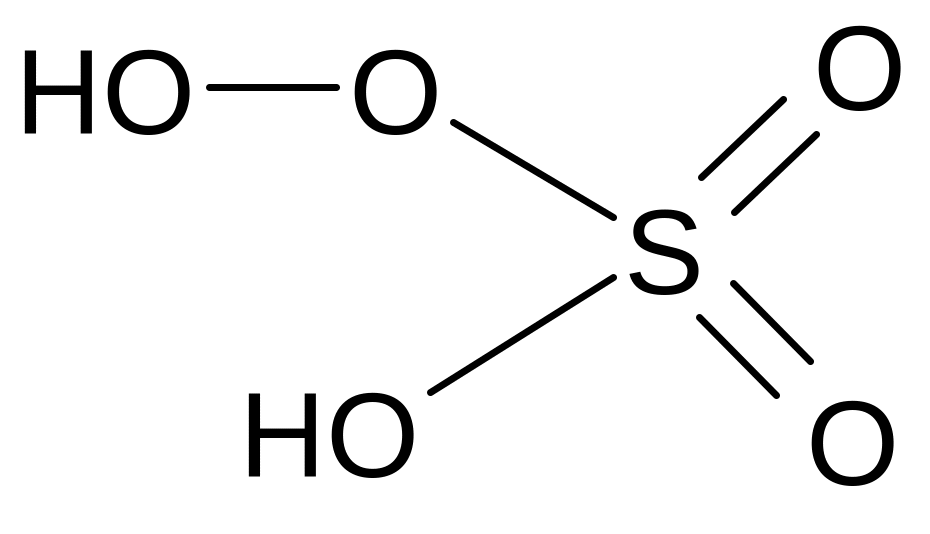
Кислота одноосновная, образует соли, которые мало устойчивы. Кислота подвергается гидролизу:
H2SO5 + H2O = H2SO4 + H2O2
Данная реакция используется для получения Н2О2 в технике. H2SO5 – сильный окислитель, взаимодействует со многими органическими веществами, иногда со взрывом.
Надсерная кислота
Молекулярная формула - H2S2O8
Графическая формула
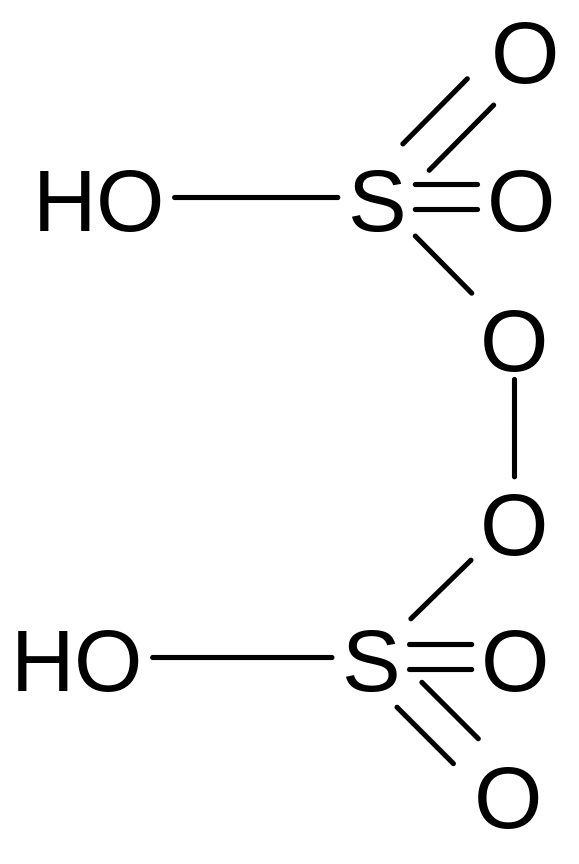
Надсерная кислота или пероксодисерная кислота, мало устойчива.
H2S2O8 + 2 H2O = 2 H2SO4 + H2O2
H2S2O8 + H2O2 = 2 H2SO5
Соли надсерной кислоты перексосульфаты (VI) – сильные окислители. Используются при проведении химического анализа. Обугливает бумагу, сахар и парафин. Используются для обнаружение катионов марганца.
2 MnSO4 + 5 (NH4)2S2O8 + 8 H2O = 2 HМnO4 + 5 (NH4)2SO4 + 7 H2SO4
M n+2
- 5e = Mn+7
2
n+2
- 5e = Mn+7
2
(S2O8)2- + 2e = 2SO42- 5
Серная кислота
Физические свойства
Молекулярная формула H2SO4
Графическая формула
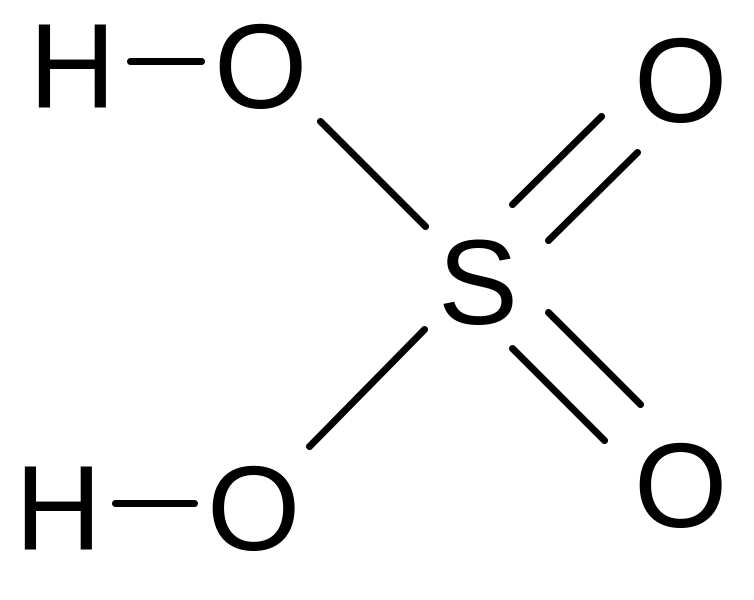
Безводная H2SO4 при обычных условиях – бесцветная маслянистая жидкость, не имеющая запаха, нелетучая. Она растворяется в воде в неограниченных количествах, при этом выделяется большое количество теплоты, так как происходит образование гидратов
Химические свойства
H2SO4 - cильная кислота.
Ступенчатая диссоциация:
1-я ступень: H2SO4 ⇆ H⁺+HSO₄-
2-я ступень: HSO₄-⇆H⁺+SO₄2-
Можно считать, что в разбавленных растворах диссоциирована полностью:
H2SO4 ⇆ 2H++SO42-
Химические свойства разбавленной и концентрированной различаются.
Разбавленная H2SO4 проявляет общие свойства кислот, обусловленные наличием H+.
Разбавленная H2SO4 взаимодействует:
С Ме (до H):
H2SO4 + Zn = H2 + ZnSO4;
С основными и амфотерными оксидами:
H2SO4 + MgO = MgSO4 + H2O;
3 H2SO4 + Al2O3 = Al2(SO4)3 +3H2O;
С основаниями и амфотерными гидроксидами:
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O;
3 H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O;
С солями слабых кислот:
H2SO4 + Na2CO3 = Na2SO4 + CO2 +H2O
С аммиаком:
H2SO4 + NH3 = NH4HSO4;
H2SO4 + 2NH3 = (NH4)2SO4
Концентрированная h2so4 –сильный окислитель
Окисление металлов.
Концентрированная серная кислота растворяет не только металлы, расположенные в ряду напряжений до водорода, но и такие малоактивные металлы, как Cu, Hg, Ag. Водород при этом не выделяется, поскольку роль окислителя в конц. H2SO4 играют анионы SO42- , а не ионы H+.
Продукты восстановления H2SO4 зависят от активности металла:
Реакция с мало-и среднеактивными Ме:
2 H2SO4 + Cu = CuSO4 + SO2↑ + 2H2O;
Реакции с активными Ме:
4 H2SO4 +3Zn = 3ZnSO4 + S↓ + 4H2O;
Реакции со щелочными и щелочно-земельными Ме:
5 H2SO4 + 8Na = 4 Na2SO4 + H2S↑ + 4H2O
