
- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Тиосульфаты
Na2SO3 + S = Na2S2O3 натриевая соль тиосерной кислоты (тиосульфат натрия).
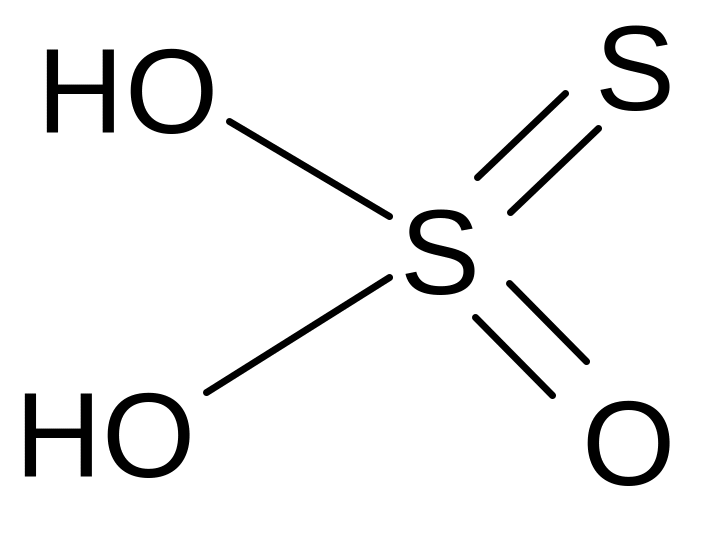
Тиосерная кислота (H2S2O3) – неустойчива, при комнатной температуре распадается. Соли более устойчивы, из них наиболее употребителен тиосульфат натрия Na2S2O3•5H2O. При добавлении к раствору тиосульфата натрия какой-нибудь кислоты, появляется запах SO2, затем раствор мутнеет от выделившейся серы (на этом основано лечение чесотки).
Na2S2O3 + 2 HCl = H2S2O3 + 2 NaCl
H2S2O3 = H2O + SO2↑ + S↓
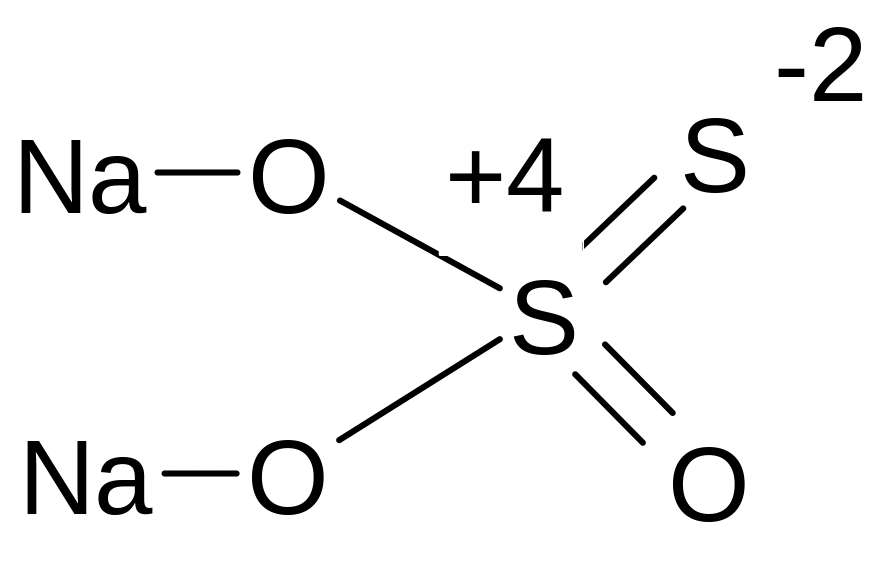
степень окисления серы +4 и -2. Поэтому сера может быть восстановителем.
Na2S2O3 + 4 Cl2 + 4 H2O = H2SO4 + 2 NaCl + 6 HCl ; S+4 -2ẽ = S+6
2 Na2S2O3 + I2 = 2 NaI + Na2S4O6 соль тетратионовой кислоты.
I2 - менее сильный окислитель.
Эта реакция служит основой одного из методов количественного химического анализа (иодометрии). Тиосульфаты образуют с солями серебра комплексные соединения содержащие ионы: [Ag(S2O3)2 ]3-, [Ag(S2O3)]- . Эти комплексы хорошо растворимы в воде.
Тиосульфат натрия Na2S2O3, прибавленный к соли меди, обесцвечивает раствор, образуется комплексная соль. При нагревании полученного раствора образуется темно-бурый осадок Cu2S.
2 CuSO4 + 2 Na2S2O3(ИЗБ) = Na2SO4 + Na2S4O6 + Cu2SO4
Cu2SO4 + Na2S2O3 = Na2SO4 + Cu2S2O3
Cu2S2O3 + Na2S2O3 = Na2[Cu2(S2O3)2]
Na2[Cu2(S2O3)2] + H2SO4 = Na2SO4 + H2[Cu2(S2O3)2]
H2[Cu2(S2O3)2] + H2O H2SO4 + SO2↑ + S + Cu2S↓
Политионовые кислоты. Политионаты
Тетратионовая кислота
Молекулярная формула - H2S4O6
Графическая формула
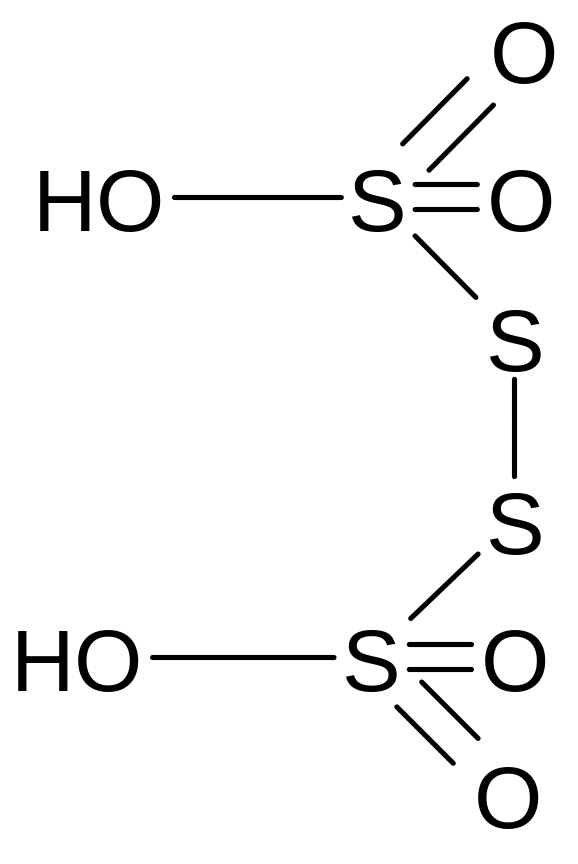
Тетратионовая кислота принадлежит к группе политионовых кислот. Это двухосновные кислоты общей формулой Н2SxO6, где х может принять значения от 2 до 6. они неустойчивы. Их соли более устойчивы – политионаты.
Дитионовая кислота
Молекулярная формула - H2S2O6
Графическая формула
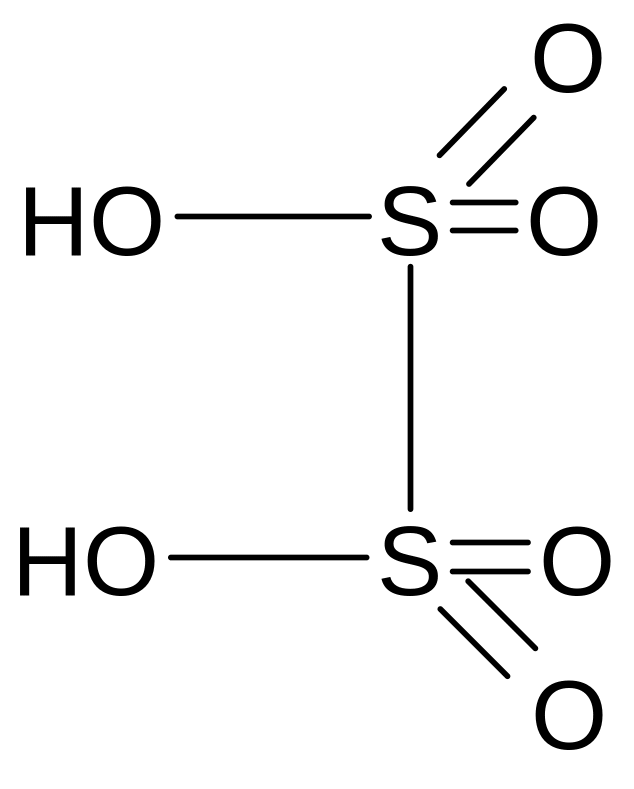
Дитионовая кислота, известна только в растворе.
Получают:
2 MnO2 + 3 SO2 = MnSO4 + MnS2O6
MnS2O6 + H2SO4 = H2S2O6 + MnSO4
H2S2O6 = H2SO4 + SO2 по отношению к окислителям устойчива.
Ее соли большей частью хорошо кристаллизуются и все легко растворимы в воде.
Соединения серы (VI).SO3 - oксид серы.
Физические свойства.
SO3 - триоксид серы, серный ангидрид. Бесцветная жидкость, хорошо растворим в воде, химически с ней взаимодействует, образуя серную кислоту. Реакция очень экзотермична.
Химические свойства.
SO3 - кислотный оксид:
Взаимодействует с водой, основными оксидами и щелочами:
SO3+H2O=H2SO4 - серная кислота
2SO3+H2O=H2S2O7 – пиросерная кислота
SO3+CaO=CaSO4
SO3+2NaOH=Na2SO4+H2O
SO3 - очень сильный окислитель:
SO3+H2S=SO2+H2O
5SO3+2P=5SO2+P2O5
SO3 - эффективный водоотнимающий агент:
Вследствие сильного сродства к воде серный ангидрид часто отнимает от веществ химически связанную воду, например, обугливает органические соединения:
SO3+C6H12O6=SO3×6H2O+6C
Образование олеума – сильнейшего окислителя.
SO3 - обладает необычным свойством – неограниченно растворяется в концентрированной H2SO4, при этом образуется смесь полисерных кислот (олеум):
nSO3+H2SO4=H2SO4×nSO3
Олеум - густая маслянистая жидкость, дымящая на воздухе, содержащая смесь:
H2SO4, H2S2O7, H2S3O10, H2S4O13
серная двусерная трисерная тетрасерная

полисерные кислоты
Графическая формула тетрасерной кислоты
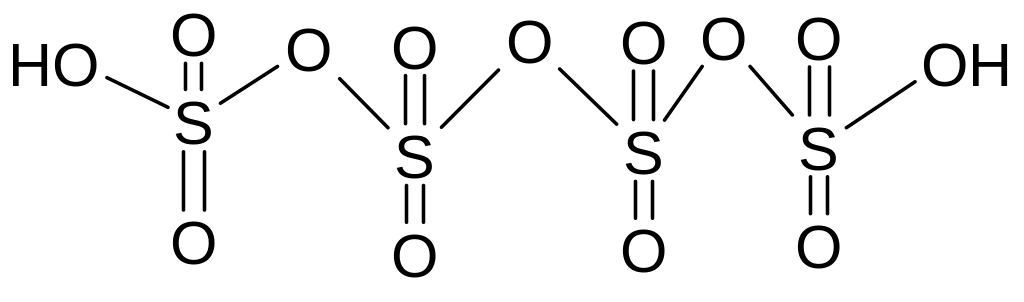
H2SO4•nSO3 - полисерная кислота, общая формула.
