
- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Ортофосфорная кислота – h3po4
Это трехосновная кислота средней силы. Диссоциация протекает в основном по первой ступени:
H3PO4 ↔ H+ + H2PO4-
По второй и третьей ступеням диссоциация протекает в ничтожно малой степени:
H2PO4- ↔ H+ + HPO42-
HPO42-↔ H+ + PO43-
Физические свойства
При обычной температуре безводная ортофосфорная кислота представляет собой прозрачное кристаллическое вещество, очень гигроскопичное и легкоплавкое. Смешивается с водой в любых соотношениях.
Способы получения
Исходным сырьем для промышленного получения H3PO4 служит природный фосфат Сa3(PO4)2:
трехстадийный синтез:
+C, +SiO2 +O2
Ca3(PO4)2 → P → P2O5 → H3PO4
обменное разложение фосфорита серной кислотой:
Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4↓
Получаемая по этому способу кислота загрязнена сульфатом кальция.
окисление фосфора азотной кислотой (в лаборатории):
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑
Химические свойства
О
 ртофосфорная
кислота проявляет общие свойства
кислот:
ртофосфорная
кислота проявляет общие свойства
кислот:
2H3PO4 + 6Na = 2Na3PO4 + 3H2↑
2H3PO4 + 3CaO = Ca3(PO4)2 + 3H2O
В отличие от аниона NO3- в азотной кислоте, анион PO43- окисляющим действием не обладает.
Качественная реакция на анион PO43-:
Реактивом является раствор AgNO3, при добавлении которого образуется нерастворимый желтый фосфат серебра: PO43- + 3Ag+ = Ag3PO4↓
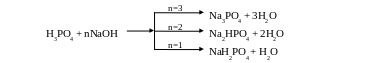
Cоли ортофосфорной кислоты – фосфаты
H3PO4 как трехосновная кислота образует три типа солей, которые имеют большое практическое значение.
Название |
Анион соли |
Растворимость в воде |
Примеры солей |
Фосфаты |
PO43- |
большинство нерастворимо (кроме фосфатов щелочных металлов и аммония) |
Na3PO4, Ca3(PO4)2 |
Гидрофосфаты |
HPO42- |
растворимы |
Na2HPO4, CaHPO4 |
Дигидрофосфаты |
H2PO4- |
очень хорошо растворимы |
NaH2PO4, Ca(H2PO4)2 |
Растворимые соли фосфорной кислоты в водных растворах подвергаются гидролизу.
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
Тема: р-элементы VI группы
Ключевые слова: p-элементы, сера, гомоцепи, ромбическая сера, сульфид водорода (сероводород), сульфиды металлов, сульфиды неметаллов, полисульфиды, сернистая кислота, сульфиты, гидросульфиты, тиосульфаты, политионаты, серная кислота, сульфаты, гидросульфаты, олеум, дисерная кислота, пиросерная кислота, пироксомоно- и пироксодисерная кислота, дисульфидные мостики, сульфгидрильные группы.
8О 1s22s22p4
16S [Ne]3s23p4
34Se [Ar]3d104s24p4
52Te [Kr]4d105s25p4
84Po [Xe]4f145d106s26p4
Элементы главной подгруппы VI группы носят общее групповое название «халькогены». Их атомы являются электронными аналогами, поскольку имеют одинаковое строение внешнего электронного слоя (ns2np4). Это р-элементы, неметаллы (кроме полония). Валентность II, IV, VI. Степени окисления -2, +2, +4, +6 (кислород исключение).
