
- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
N2o3 – оксид азота (III) или азотистый ангидрид.
N2O3 – представляет собой темно-синюю жидкость, уже при низких температурах разлагающуюся на NO и NO2 при охлаждении вновь образуется N2O3:
NO + NO2 = N2O3
Оксиду азота (III) как и соответствующая ему азотистая кислота HNO2, проявляют свойства восстановителя и окислителя. Практического применения не нашел.
N2o5 – оксид азота (V) или азотный ангидрид.
N2O5 – белые кристаллы, уже при комнатной температуре постепенно разлагающиеся на NO2 и O2. Он может быть получен действием фосфорного ангидрида на азотную кислоту:
2 HNO3 + P2O5 = N2O5 + 2 HPO3
Оксид азота (V) – очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются. В воде оксид азота (V) хорошо растворяется с образованием азотной кислоты.
N2O5 + H2O = 2HNO3
Разложение на свету:
hν
2N2O5 = 4NO2 + O2
Азотистая кислота и нитриты
Молекулярная формула – HNO2
Графическая формула: H-O-N=O
При действии на раствор какого-нибудь нитрита разбавленной серной кислотой получается свободная азотистая кислота:
2 NaNO2 + H2SO4 = Na2SO4 + 2 HNO2
Она принадлежит к числу слабых кислот и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается:
2 HNO2 = NO + NO2 + H2O
Степень окисления азота в азотистой кислоте равна +3, т.е. является промежуточной между низшими и высшей из возможных значений степени окисленности азота. Поэтому HNO2 проявляет окислительно-восстановительную двойственность. Под действием восстановителей она восстанавливается (обычно до NO), а в реакциях с окислителями – окисляется до HNO3. Примерами могут служить следующие реакции:
2 HNO2 + 2 KI + H2SO4 = 2 NO↑ + I2 + K2SO4 + 2 H2O
5 HNO2 + 2 KMnO4 + 3 H2SO4 = 5 HNO3 + 2 MnSO4 + K2SO4 + 3 H2O.
Соли азотистой кислоты – нитриты – образуют кристаллы, хорошо растворимые в воде (за исключением нитрита серебра). Нитрит натрия NaNO2 применяется при производстве различных красителей. В отличие от самой азотистой кислоты, ее соли устойчивы. Нитриты токсичны.
Способы получения
Пропускание эквимолярной смеси оксидов азота II и IV в раствор щелочи:
NO + NO2 + 2NaOH = 2NaNO2 + H2O
Обменные реакции между NaNO2 и солями металлов:
NaNO2 + AgNO3 = AgNO2↓ +NaNO3
Если нагревать нитрат калия или натрия, то они теряют часть кислорода и переходят в соли азотистой кислоты HNO2. Разложение идет легче в присутствии свинца, связывающего выделяющийся кислород:
KNO3 + Pb = KNO2 + PbO
Химические свойства
Как и азотистая кислота, нитриты обладают окислительно-восстановительной двойственностью:
KNO2 + H2O2 = KNO3 + H2O
3KNO2 + 2KMnO4 + H2O = 3KNO3 + 2MnO2↓ + 2KOH
2KNO2 + 2KI + 2H2SO4 = 2NO + I2 + 2K2SO4 + 2H2O
NH4NO2 = N2↑ + 2H2O
Азотная кислота.
Молекулярная формула – HNO3
Валентная схема молекулы азотной кислоты:
.. ..
H : O : N : : O
˙˙ ˙˙ ˙˙
:O:
˙˙
или H-O-N=O
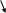
O
Атом азота образует три связи с атомами кислорода по обменному механизму и одну связь – по донорно-акцепторному механизму.
