
- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Кремнийорганические соединения
Для кремния известно большое число соединений, в которых атомы кремния химически связаны с атомами углерода. Эти соединения называются кремнийорганическими.
Наиболее простейшими из них являются:
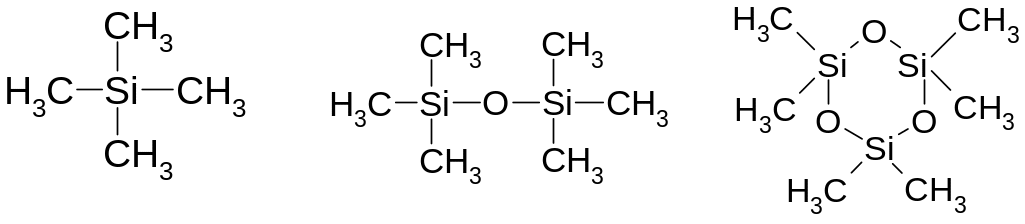
Кремнийорганические соединения устойчивы на воздухе и нерастворимы в воде. Синтез высокомолекулярных производных этого типа открыл возможность их широкого практического использования для выработки лаков и смол, характеризующихся высокой термической устойчивостью. Интересной особенностью обладают некоторые из подобных продуктов, называемых силиконами. Они обладают крайне незначительным изменением вязкости в весьма широком интервале температур.
Путем гидролиза частично галоидозамещенных кремневодородов был получен ряд производных кремния, называемых силоксанами и характеризующихся наличием в молекуле группировки ≡Si─O─Si≡. Силоксаны бесцветные газообразные или жидкие вещества, легко загорающиеся на воздухе, быстро разлагаемые щелочами и медленно водой.
Использование соединений кремния в медицине
По содержанию в организме человека (10 ˉ3 %) кремний относится к примесным микроэлиментам. Больше всего кремния в печени, надпочечниках, волосах, хрусталике. Так как природный кремний диоксид плохо растворим в воде, то в организм человека он попадает не столько через пищеварительный тракт, сколько воздушным путем через легкие в виде пылеобразного SiO2.
С нарушением обмена кремния связывают возникновение гипертонии, ревматизма, язвы, малокровия. Недавно было установлено, что кремний содержится в коже, хрящах, связках млекопитающих и входит в состав мукополисахаридов, где прочно связан эфирными связями. В отличие от углерода в составе биомолекул кремний связан только с атомами кислорода.
В медицинской практике применяют кремний (IV) карбид SiC – карборунд для шлифовки пломб и пластмассовых протезов.
При систематическом воздействии на легкие пыли, состоящей из частиц угля, диоксида кремния, алюминия возникает заболевание – пневмокониозы. При действии угольной пыли – антракоз – профессиональное заболевание шахтеров. При вдыхании пыли, содержащей SiO2, возникает силикоз, при действии алюминиевой пыли – алюминоз.
Тема: р-элементы V группы
Ключевые слова: p-элементы, азот, фосфор, мышьяк, типические элементы, нитриды, аммиак, амиды, аммиакаты, ион аммония, соли аммония, гидрозин, гидроксиламин, аминокислоты, амфотерность, имиды, аминогруппа, оксиды, азотистая кислота, нитриты, азотная кислота, нитраты, кальцевая силитра, натриевая силитра, каливая силитра, аллотропия фосфора, гидроксоапатит, фторапатит, белый, черный и красный фосфор, фосфиды, фосфин, фосфорная кислота, фосфаристая кислота, фосфорноватичтая кислота, пирофосфорная, метафосфорная кислота.
Элементы главной подгруппы V группы – азот N, фосфор Р, мышьяк As, сурьма Sb, висмут Bi. Согласно электронным конфигурациям их атомов
N 1s22s22p3
P 2s22p63s23p3
As 3s23p63d104s24p3
Sb 4s24p64d105s25p3
Bi 4s24p64d104f145s25p65d106s26p3
Сходство элементов:
одинаковая структура внешнего электронного слоя атомов ns2np3
р-элементы
высшая степень окисления равна +5
низшая степень окисления равна -3 (для Sb и Bi малохарактерна)
Азот и фосфор относятся к типическим элементам, а мышьяк, сурьму и висмут объединяют в подгруппу мышьяка. В ряду As-Sb-Bi размеры атомов и ионов увеличиваются, энергии ионизации уменьшаются. Этим обусловлено ослабление признаков неметаллических элементов и усиление признаков металлических элементов.
Валентные состояния атомов:
Для атомов P, As, Sb, Bi возможны два валентных состояния:
основное ns2np3
в
nd
озбужденное ns1np3nd1
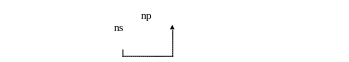


Соответствующие этим состояниям валентности: III и V.
Отличие азота от других элементов подгруппы
В связи с отсутствием в атоме азота d-орбиталей на внешнем электронном слое число ковалентных связей, образуемых атомом азота по обменному механизму, не может быть больше трех.
Наличие неподеленной электронной пары на 2s-подуровне атома азота обуславливает возможность образования ковалентной связи по донорно-акцепторному механизму. Таким образом, высшая валентность азота равна IV.
В соединениях с кислородом азот проявляет степени окисления +1, +2, +3, +4, +5.
В отличие от галогенов и халькогенов, в главной подгруппе V группы наблюдается более резкое изменение свойств элементов и образуемых ими простых веществ по мере увеличения заряда ядра и радиуса атомов:
N 2
(газ) P (тв.)
As (тв.) Sb (тв.)
Bi (тв.)
2
(газ) P (тв.)
As (тв.) Sb (тв.)
Bi (тв.)
