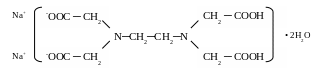- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Химические свойства
Взаимодействие с кислородом:
Из элементов I группы только литий образует оксид:
4Li + O2 → 2Li2O
Натрий при горении образует пероксид:
2Na + O2 → Na2O2
Пероксиды щелочных металлов можно считать солями пероксида водорода. В водном растворе они гидролизуются как соли слабой кислоты:
Na2O2 + H2O ↔ NaOH + NaHO2
Супероксиды (надпероксиды) характерны для калия, рубидия, цезия.
К + О2 → КО2
Они легко разлагаются, выделяя свободный кислород:
2КО2 + 2Н2О → 2КОН + Н2О2 + О2↑
Озониды известны для калия, рубидия, цезия.
К + О3 → КО3
При взаимодействии с водой они выделяют наибольшее количество кислорода:
2КО3 + Н2О → 2КОН + 2,5О2↑
При взаимодействии S-металлов с водородом образуются гидриды:
2Li + H2 → 2LiH (t)
Ca + H2 → CaH2 (t)
Для гидридов характерны восстановительные свойства:
NaH + H2O → NaOH + H2↑
NaH + HCl → NaCl + H2↑
BaH2 + 2H2O → Ba(OH)2 + 2H2↑
BaH2 + 2HCl → BaCl2 + 2H2↑
S-металлы активно реагируют с водой и кислотами:
2Na + H2O → 2NaOH + H2↑
2Na + 2HCl → 2NaCl + H2↑
2Na + H2SO4(p) → Na2SO4 + H2↑
Ca + 2H2O → Ca(OH)2 +H2↑
Mg + H2O (хол) ≠
Mg + 2H2O (гор) → Mg(OH)2↓ + H2↑
Ca + 2HCl → CaCl2 + H2↑
Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
Ме(ОН) – общая формула гидроксидов S-металлов I группы. Называют их щелочами. Они хорошо растворимы в воде. Очень агрессивные, едкие вещества. Используются во многих реакциях органического и неорганического синтеза.
Ме(ОН)2 – общая формула гидроксидов S-металлов II группы.
Mg(OH)2 – нерастворимое основание
Ca(OH)2 – сильное основание (щелочь)
Be(OH)2 – амфотерный гидроксид. В воде он нерастворим, но легко растворяется как в кислотах, так и в щелочах:
Ве(OH)2 + 2NaOH → Na2[Be(OH)4]
Be(OH)2 + 2HCl → BeCl2 + 2H2O
Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
NaCl, KCl, CaCl2 - хлориды
Na2SO4, K2SO4, CaSO4 - сульфаты
Na2CO3, K2CO3, CaCO3 - карбонаты
Na3PO4, K3PO4, Ca3(PO4)2 - фосфаты
NaCl – хлорид натрия, поваренная или каменная соль; пищевой продукт, консервирующее средство, сырье для получения соды, Na2CO3, хлора, NaOH. Изотонический раствор NaCl (0,9%) используется в медицине (физиологический раствор).
NaBr – бромид натрия; применяется как седативное средство в медицине.
NaHCO3 - гидрокарбонат натрия, питьевая или пищевая сода.
Водные растворы имеют слабощелочную среду в результате гидролиза:
NaHCO3 + H2O ↔ H2CO3 + NaOH
Поэтому используются как лекарственное средство для понижения кислотности желудочного сока.
Na2SO4∙10H2O – сульфат натрия (десятиводный), глауберова соль, используемая как слабительное.
Na2B4O7∙10H2O – декагидрат тетрабората натрия – бура, применяется как антисептическое средство для полосканий, спринцеваний и т.д.
KMnO4 – перманганат калия, используется в медицине как дезинфицирующее средство.
CaSO4∙2H2O – дигидрат сульфата кальция, используется в хирургии при переломах для изготовления гипсовых повязок.
Ионы щелочных и щелочноземельных металлов входят в состав комплексных соединений как комплексообразователи, в живых организмах эти металлы образуют комплексы с белками или другими биолигандами. Например, Mg2+ играет роль комплексообразователя в одном из важнейших соединений растительного мира – пигмента хлорофилла.
Для живых систем характерны комплексы, содержащие полидентантные органические лиганды типа комплексонов. Примером подобных веществ может служить синтетический препарат трилон Б – двуводный кристаллогидрат двунатриевой соли ЭДТА (этилендиаминтетрауксусной кислоты):
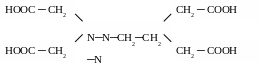
ЭДТА