
- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Химические свойства углерода
О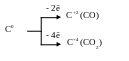 бе
модификации углерода (алмаз и графит)
химически весьма инертны. Мелкокристаллические
формы графита – кокс, сажа, активированный
уголь – более реакционноспособны, но,
как правило, после их предварительного
нагревания до высокой температуры.
Углерод проявляет восстановительные
свойства.
бе
модификации углерода (алмаз и графит)
химически весьма инертны. Мелкокристаллические
формы графита – кокс, сажа, активированный
уголь – более реакционноспособны, но,
как правило, после их предварительного
нагревания до высокой температуры.
Углерод проявляет восстановительные
свойства.
Реакции с более электроотрицательными неметаллами
Взаимодействие с кислородом
С(графит) + О2 (г) ═ СО2 (г)
2С + О2 = 2СО
Сжигание угля – один из важнейших источников энергии.
Взаимодействие с фтором и серой
С + 2F2 CF4 тетрафторид углерода
C + 2S CS2 сероуглерод
Реакции с оксидами металлов (карботермия)
Кокс – один из важнейших восстановителей, используемых в промышленности. В металлургии с его помощью получают металлы из их оксидов, например:
2С + Fe2O3 2Fe + 3CO
При взаимодействии углерода с оксидами щелочных и щелочноземельных металлов восстановленный металл, соединяясь с углеродом, образует карбид. Например:
3C + CaO CaC2 + CO
Реакции с кремнеземом
Кокс применяется также для получения кремния:
2С + SiO2 Si + 2CO
При избытке кокса образуется карбид кремния (карборунд) SiC.
Получение «водяного газа» (газификация твердого топлива)
Пропусканием водяного пара через раскаленный уголь получают горючую смесь СО и Н2, называемую водяным газом:
С + Н2О СО + Н2
Реакции с окисляющими кислотами
Активированный или древесный уголь при нагревании восстанавливает анионы NO3- и SO42- из концентрированных кислот:
C + 4HNO3 CO2↑ + 4NO2↑ + 2H2O
C + 2H2SO4 CO2↑ + 2SO2↑ + 2H2O
Реакции с расплавленными нитратами щелочных металлов
В расплавах KNO3 и NaNO3 измельченный уголь интенсивно сгорает с образованием ослепительного пламени:
5C + 4KNO3 2K2CO3 + 3CO2↑ + 2N2↑
С – малоактивный окислитель:
С0 + 4ē → С-4
Образование солеобразных карбидов с активными металлами.
Значительное ослабление неметаллических свойств у углерода выражается в том, что функции его как окислителя проявляются в гораздо меньшей степени, чем восстановительные функции.
Только в реакциях с активными металлами атомы углерода переходят в отрицательно заряженные ионы С-4 и (С≡С)2-, образуя солеобразные карбиды:
3С + 4Al Al4C3 карбид алюминия
2C + Ca CaC2 карбид кальция
Карбиды ионного типа – очень нестойкие соединения, они легко разлагаются под действием кислот и воды, что свидетельствует о неустойчивости отрицательно заряженных анионов углерода:
Al4C3 + 12H2O = 3CH4↑ + 4Al(OH)3
CaC2 + 2H2O = C2H2↑ + Ca(OH)2
Образование ковалентных соединений с металлами
В расплавах смесей углерода с переходными металлами образуются карбиды преимущественно с ковалентным типом связи. Молекулы их имеют переменный состав, а вещества в целом близки к сплавам. Такие карбиды отличаются высокой устойчивостью, они химически инертны по отношению к воде, кислотам, щелочам и многим другим реагентам.
Взаимодействие с водородом
При высоких температуре и давлении, в присутствии никелевого катализатора, углерод соединяется с водородом:
С
+ 2H2
![]() CH4
CH4
