
- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Гидриды бора (бораны)
При действии соляной кислоты на борид магния Мg3В2 получается сложная смесь различных бороводородов.
Mg3B2 + 6HCl → B2H6 + 3MgCl2
Из этой смеси выделены в чистом виде следующие бороводороды:
B2H6; B4H10; B5H9; B5H11; B6H10; B10H14
газообразный жидкие твердый
Главным продуктом взаимодействия борида магния с соляной кислотой является тетраборан В4Н10 — летучая жидкость с очень неприятным запахом, пары которой воспламеняются на воздухе. При хранении тетраборан постепенно разлагается с образованием простейшего из полученных бороводородов — диборана В2Н6. Последний представляет собой газ. На воздухе он не загорается, но водой тотчас же разлагается с отщеплением водорода и образованием борной кислоты Н3ВО3:
В2Н6 + 6 Н2О = 2 Н3ВО3 + 6 Н2
Атомы бора в молекулах бороводородов связаны друг с другом водородными «мостиками», на пример:
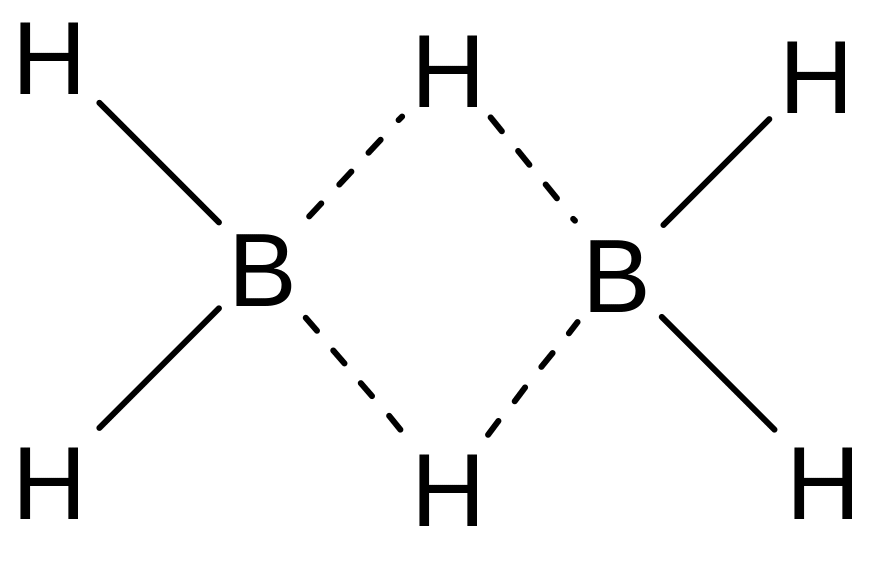
Пунктиром на этой схеме показаны трехцентровые связи: здесь общая пара электронов занимает молекулярную орбиталь, охватывающую три атома - «мостиковый» атом водорода и оба атома бора. Такая орбиталь образуется вследствие перекрывания 1s-орбитали атома водорода с sр3-гибридными орбиталями двух атомов бора. Четыре «концевых» атома водорода связаны с атомами бора обычными двухцентровыми двухэлектронными связями. Таким образом, из двенадцати валентных электронов, имеющихся в атомах, составляющих молекулу диборана, восемь участвуют в образовании двухцентровых связей В ─ Н, а четыре образуют две трехцентровые связи В ─ Н ─ В.
Гидридобораты. Галиды бора
Гидридобораты известны для многих элементов. Тетрагидридобораты щелочных и щелочно-земельных металлов являются преимущественно ионными соединениями, т.е. типичными солями. В твердом состоянии они вполне устойчивы. В практике чаще всего используется Nа[ВН4] - бесцветная соль, хорошо растворимая в воде. При обычных температурах гидролизуется очень медленно.
Гидридобораты щелочных металлов можно получить взаимодействием соответствующего гидрида с дибораном:
2 LiH + B2H6 ═ 2 Li[BH4]
Для получения Nа[ВН4] обычно используется реакция между гидридом натрия и метиловым эфиром ортоборной кислоты:
4 NaH + B(OCH3)3 ═ Na[BH4] + 3 CH3ONa
Тетрагидридобораты других металлов обычно получают обменной реакцией между Nа [ВН4] и соответствующим галогенидом, например:
3 Nа[ВН4] + AlCl3 ═ Al(BH4)3 + 3 NaCl
Гидробораты – сильные восстановители. Они широко используются для проведения различных синтезов, применяются как исходные вещества для получения различных гидридов и в особенности диборана:
3 Nа[ВН4] + 4 BF3 ═ 2 B2H6 + 3 Na[BF4]
Галоидные соединения бора представляют собой бесцветные вещества, вследствие гидролиза дымящие во влажном воздухе. Фтористый бор (BF3) при обычных условиях газообразен, BCl3 – кипит при +18° С, BBr3 – жидкость и BJ3 – твердое вещество. В водном растворе все они подвергаются гидролизу по схеме:
BHal3 + 3 H2O ═ B(OH)3 + 3 HHal
Для галогенидов бора весьма характерны реакции присоединения к ним молекул различных других веществ, в частности, ряда органических соединений.
При образовании комплексов галогенида бора с другими веществами атом бора выступает в качестве акцептора. Поэтому присоединяться к молекулам BHal3 способны только молекулы, содержащие в своем составе атом с достаточно отчетливо выраженной донорной функцией. Склонность молекул BHal3 к комплексообразованию по ряду F – Cl – Br – J довольно быстро уменьшается.
BCl3 + 3NaCl → Na3[BCl6]
