
- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Соединения марганца (III)
Mn2O3 – амфотерный оксид, с преобладанием основных свойств.
Химические свойства
Mn2O3 + 6HF = 2MnF3 + 3H2O
Mn+32O3 + NaOH = 2NaMnO2 + H2O (t)
Mn(OH)3 – гидроксид Mn3+ - амфотерное соединение, с преобладанием основных свойств:
Mn(OH)3 ↔ HMnO2
Соединения марганца (IV)
К основным соединениям четырехвалентного марганца относятся оксид марганца (IV) MnO2, а также марганцеватистая кислота H2MnO3 – очень неустойчивая, легко разлагающаяся на оксид марганца (IV) и воду.
С амым
прочным соединением марганца (IV)
является нерастворимый в воде оксид
темно-бурого цвета. Это амфотерное
соединение, но соответствующие свойства
выражены крайне слабо.
амым
прочным соединением марганца (IV)
является нерастворимый в воде оксид
темно-бурого цвета. Это амфотерное
соединение, но соответствующие свойства
выражены крайне слабо.
M
амфотерность
MnO2 + 2NaOH = Na2MnO3 + H2O
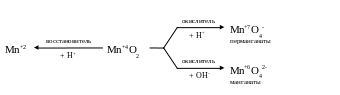
MnO2 может проявлять в ОВ-реакциях в зависимости от природы партнера как окислительные, так и восстановительные свойства (окислительно-восстановительная двойственность).
Гораздо чаще используют оксид марганца (IV) в качестве окислителя, проводя реакции в кислой среде:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
В щелочной среде оксид марганца (IV) может быть и восстановителем, превращаясь в соединения марганца (VI), например, соли марганцовистой кислоты – манганаты:
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O
Влияние рН на ов-реакции MnO2
Соединения марганца (VI)
MnO3 – оксид, обладает кислотными свойствами.
H2MnO4 – марганцовистая кислота – существует только в растворе.
Соли этой кислоты – манганаты.
Манганаты могут быть получены прокаливанием сухих перманганатов:
+7 -2 +6 +4 0
2KMnO4 K2MnO4 + MnO2 + O2↑
Манганаты устойчивы в сильнощелочной среде, в нейтральной среде протекает реакция диспропорционирования:
+6 +7 +4
3Na2MnO4 + 2H2O → 2NaMnO4 + MnO2 + 4NaOH
Соединения марганца (VII)
Высшей степени окисления марганца +7 соответствует кислотный оксид Mn2O7, марганцевая кислота HMnO4 и ее соли – перманганаты.
Соединения марганца (VII) – сильные окислители. Mn2O7 – зеленовато-бурая маслянистая жидкость, при соприкосновении с которой спирты и эфиры воспламеняются. Оксиду Mn (VII) соответствует марганцевая кислота HMnO4. Она существует только в растворах, но считается одной из самых сильных (α – 100%). Максимально возможная концентрация HMnO4 в растворе – 20%. Соли HMnO4 – перманганаты – сильнейшие окислители; в водных растворах, как и сама кислота, имеют малиновую окраску.
В окислительно-восстановительных реакциях перманганаты являются сильными окислителями. В зависимости от реакции среды они восстанавливаются либо до солей двухвалентного марганца (в кислой среде), оксида марганца (IV) (в нейтральной) или соединений марганца (VI) – манганатов – (в щелочной). Очевидно, что в кислой среде окислительные способности Mn+7 выражены наиболее ярко.
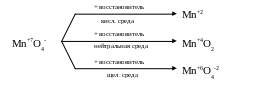
+7 +4 +2 +6
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
+7 +4 +4 +6
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 3Na2SO4 + 2KOH
+7 +4 +6 +6
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
+7 +2
2KMnO4 + 3H2SO4 + 5C2H5OH → 2MnSO4 + K2SO4 + 5CH3COH + 8H2O
спирт альдегид
+7 +4 +6
4KMnO4 + 2NaOH + C2H5OH → MnO2↓ + 3CH3COH + 2K2MnO4 +
+6
Na2MnO4 + 4H2O
При нагревании перманганат калия разлагается (эта реакция применяется для получения кислорода в лабораторных условиях):
2KMnO4 K2MnO4 + MnO2 + O2↑
Таким образом, для марганца характеры те же зависимости: при переходе от низшей степени окисления к высшей нарастают кислотные свойства кислородных соединений, а в ОВ-реакциях восстановительные свойства сменяются окислительными.
Для организма перманганаты ядовиты вследствие сильных окислительных свойств.
При отравлениях перманганатами в качестве антидота используют пероксид водорода в уксуснокислой среде:
+7 -1 +2 0
2KMnO4 + 5H2O2 + 6CH3COOH → 2(CH3COO)2Mn + 2CH3COOK + 5O2↑ + 8H2O
Раствор KMnO4 является прижигающим и бактерицидным средством для обработки поверхности кожи и слизистых оболочек. Сильные окислительные свойства KMnO4 в кислой среде лежат в основе аналитического метода перманганатометрии, используемого в клиническом анализе для определения окисляемости воды, мочевой кислоты в моче.
Организм человека содержит около 12 мг Mn в составе различных соединений, причем 43% сосредоточено в костной ткани. Он оказывает влияние на кроветворение, формирование костной ткани, рост, размножение и некоторые другие функции организма.
