
- •Оглавление
- •Тема: Химия s-элементов. Водород. Металлы.
- •Водород. Общая характеристика. Особенности положения в псэ.
- •Химические свойства водорода:
- •Химические свойства воды
- •Пероксид водорода
- •Химические свойства пероксида водорода
- •Химические свойства
- •Гидроксиды щелочных и щелочноземельных металлов. Амфотерность гидроксида бериллия.
- •Соли щелочных и щелочноземельных металлов. Химические основы применения соединений s-металлов в медицине и фармации.
- •Трилон б
- •Биороль s-элементов
- •Жесткость воды и способы ее устранения
- •Тема: d- элементы I и II группы
- •Медь. Простое вещество
- •Химические свойства
- •Cоединения меди (I)
- •Соединения меди (II)
- •Химические свойства
- •Химические свойства
- •Серебро и золото Химические свойства простых веществ
- •Соединения серебра и золота Соединения серебра (I)
- •Цинк. Простое вещество
- •Химические свойства
- •Соединения цинка
- •Химические свойства
- •Химические свойства
- •Химические свойства простых веществ кадмия и ртути в сравнении с цинком
- •Гидроксиды
- •Окислительно-восстановительные свойства соединений ртути
- •Некоторые особенности соединений ртути
- •Биологическая роль d-элементов I и II групп в живых организмах.
- •Применение в медицине и фармации соединений d-элементов I и II группы.
- •Тема: d-элементы VI группы
- •Общая характеристика металлов побочных подгрупп
- •Кислотно-основные свойства оксидов и гидроксидов
- •Хром и его соединения
- •Химические свойства хрома
- •Соединения Cr (II)
- •Химические свойства:
- •Химические свойства:
- •Химические свойства:
- •Химические свойства
- •Химические свойства
- •Примеры овр с участием дихроматов в качестве окислителей
- •Биологическое значение хрома.
- •Тема: d-элементы VII группы
- •Общая характеристика VII b-группы
- •Марганец.
- •Степени окисления марганца.
- •Химические свойства
- •Соединения марганца (III)
- •Химические свойства
- •Соединения марганца (IV)
- •Влияние рН на ов-реакции MnO2
- •Соединения марганца (VI)
- •Соединения марганца (VII)
- •Тема: d-элементы VIII группы
- •Химические свойства
- •Соединения железа (II)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения Fe(III)
- •Химические свойства
- •Химические свойства
- •Химические свойства
- •Соединения железа (VI)
- •Применение железа и железосодержащих препаратов в медицине и фармации
- •Тема: р – элементы III группы
- •Бор. Общая характеристика
- •Химические свойства
- •Гидриды бора (бораны)
- •Гидридобораты. Галиды бора
- •Кислородные соединения бора
- •Биологическая роль бора
- •Алюминий. Общая характеристика
- •Химические свойства
- •Разновидность оксида алюминия. Применение в медицине.
- •Гидроксид алюминия. Алюминаты
- •Гидрид алюминия. Квасцы
- •Применение алюминия в медицине
- •Тема: p-элементы IV группы
- •Простые вещества
- •Общая характеристика углерода.
- •Химические свойства углерода
- •Углерод в отрицательных степенях окисления
- •Оксид углерода (II)
- •Способы получения
- •Химические свойства
- •Реакции присоединения
- •Цианистоводородная кислота. Цианиды
- •Оксид углерода (IV)
- •Химические свойства
- •Угольная кислота и карбонаты
- •Химические свойства
- •Соединения углерода с серой, галогенами и азотом.
- •Биологическая роль углерода
- •Кремний. Общая характеристика
- •Физические свойства свободного кремния
- •Химические свойства
- •Соединения кремния с водородом и галогенами
- •Оксид кремния (IV)
- •Химические свойства
- •Кремниевые кислоты
- •Кремнийорганические соединения
- •Использование соединений кремния в медицине
- •Тема: р-элементы V группы
- •Оксиды и гидроксиды
- •Соединения с водородом эн3
- •Важнейшие азотсодержащие неорганические вещества
- •Способы получения
- •Химические свойства
- •Соединения азота - III
- •Аммиак Строение молекулы
- •Способы получения
- •Химические свойства
- •Соли аммония
- •Способы получения
- •Химические свойства
- •Аминокислоты
- •Гидразин и гидроксиламин
- •Азотистоводородные кислоты и азиды
- •Смесь hnn2 и hCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
- •Оксиды азота
- •Способы получения
- •Химические свойства
- •Способы получения
- •N2o3 – оксид азота (III) или азотистый ангидрид.
- •N2o5 – оксид азота (V) или азотный ангидрид.
- •Азотистая кислота и нитриты
- •Способы получения
- •Химические свойства
- •Азотная кислота.
- •Физические свойства
- •Лабораторные способы получения
- •Химические свойства
- •Применение азотной кислоты
- •Соли азотной кислоты – нитраты
- •Применение в медицине и фармации Аммиак
- •Закись азота
- •Нитрит и нитрат натрия
- •Свободный фосфор. Аллотропные модификации
- •Получение
- •Химические свойства
- •Соединения фосфора (-III). Фосфиды. Фосфин
- •Способы получения
- •Химические свойства
- •Галиды, их гидролиз
- •Оксиды фосфора
- •Способы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Фосфорные кислоты
- •Ортофосфорная кислота – h3po4
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Cоли ортофосфорной кислоты – фосфаты
- •Тема: р-элементы VI группы
- •Вертикальные изменения свойств элементов
- •Валентные состояния атомов подгруппы серы
- •Отличие кислорода от других элементов подгруппы
- •Простые вещества
- •Соединения с водородом (халькогеноводороды)
- •Свободная сера. Аллотропия. Физические свойства
- •Химические свойства серы
- •Соединения серы (II).Сероводород и сульфиды
- •Химические свойства h2s
- •Качественная реакция на сульфид-анион s2- и на h2s
- •Сульфиды
- •Обратимый гидролиз растворимых сульфидов
- •Тиосульфаты
- •Пиросерная кислота
- •Надсерная кислота
- •Серная кислота
- •Химические свойства
- •Концентрированная h2so4 –сильный окислитель
- •Пассивация Al, Fe, Cr
- •Окисление некоторых неметаллов
- •Тема: р-Элементы VII группы
- •Хлор и его соединения
- •Водный раствор hCl – сильная кислота (хлороводородная, или соляная)
- •Фтор и его соединения
- •Водный р-р hf – плавиковая кислота (фтороводородная к-та)
- •Краткая характеристика соединений брома и йода
- •Бромная вода – реактив для проведения качественных реакций
- •Галогениды
- •Биологическая роль
Биологическая роль d-элементов I и II групп в живых организмах.
Роль меди в жизнедеятельности животных и растений очень велика. Медь входит в состав ряда ферментов (гемоцианин, фенолаза, цитохромоксидаза) и некоторых белков (гемокупреин, цереброкупреин, α-амилаза и др.), функция которых связана с хранением и переносом кислорода, внутриклеточным дыханием, рядом каталитических процессов. Известно около 25 медьсодержащих ферментов и белков. Медьсодержащие ферменты катализируют различные ОВ-процессы в живых организмах. Например, цитохромоксидаза (ЦХО) катализирует завершающий этап тканевого дыхания, при этом степень окисления меди обратимо изменяется.
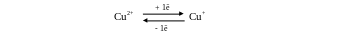
В крови моллюсков и членистоногих перенос кислорода осуществляется медьсодержащим белком гемоцианином. У высших животных медь содержится, главным образом, в печени и ядрах клеток крови (10-4 %). Суточную норму меди (~ 5мг) человек получает с пищей. Наиболее богаты медью молоко, дрожжи, моллюски, баклажаны. При недостатке меди развивается анемия. В растениях медь необходима для усвоения азота и процесса фотосинтеза.
Серебро содержится, главным образом, в головном мозге. Серебро обладает бактерицидными свойствами, то есть убивает различные микроорганизмы. Ионы Ag+ даже в ничтожно малых дозах (менее 10-6 г/л) убивают бактерии. Поэтому в медицине используют «серебряные марли», «серебряную воду», служители религии в серебряных сосудах хранят воду, где она не портится. Наиболее широкое применение в медицинской практике находят соединения серебра с белком: протаргол и колларгол.
Цинк – один из важнейших для жизни микроэлементов, необходим для нормального роста и развития животных и растительных организмов, дыхания и кроветворения. Около 100 ферментов являются цинкометаллоэнзимами (карбангидраза, карбоксипептидаза, алкогольгидрогеназа, щелочная ангидраза и др.)
В организме человека содержится 3•10-3 % цинка, главным образом, в зубах, поджелудочной железе, половых железах, коже. Суточная потребность человека в цинке 10-15мг.
Считают, что недостаток цинка в организме является причиной кариеса. В растительных организмах цинк способствует синтезу ауксинов, которые ответственны за рост растений, подъем стебля после полегания и т.д.
Хотя кадмий и ртуть обнаружены в печени и почках, их биологическая роль неясна. Соединения ртути токсичны, кадмия – высокотоксичны.
Применение в медицине и фармации соединений d-элементов I и II группы.
В качестве антисептических средств в медицине используют:
AgNO3 – «ляпис»,
CuSO4•5H2O – медный купорос,
NH2HgCl – амидохлорид ртути,
HgCl2 – сулему.
ZnSO4•7H2O – цинковый купорос – используют как вяжущее и антисептическое средство в глазных каплях.
Соединения золота повышают сопротивляемость организма туберкулезу.
NaAuS2O3 – применяют для лечения красной волчанки.
Ряд препаратов, содержащих цинк, обладают антидиабетическим действием.
Каломель (Hg2Cl2) применяют как слабительное и антигельминтное средство.
