
- •Материаловедение цветных сплавов и резин
- •Лабораторная работа 1 Исследование коррозионной стойкости конструкционных материалов
- •Общие сведения
- •Коррозионно-стойкие покрытия
- •Оборудование, инструменты и материалы для выполнения работы
- •Порядок проведения работы
- •Контрольные вопросы и задания
- •Рекомендуемая литература
- •Исследование на химическую коррозию (жаростойкость)
- •Лабораторная работа 2 Изучение влияния термической обработки на структуру и свойства дуралюмина
- •Общие сведения
- •Термическая обработка дуралюмина
- •По диаграмме состояния Al – Cu
- •Приборы и материалы
- •Методические указания и порядок выполнения работы
- •Контрольные вопросы
- •Рекомендуемая литература
- •Лабораторная работа 3 Гомогенизационный отжиг цветных металлов
- •Теоретическое введение
- •Описание оборудования
- •Порядок проведения работы и указания по охране труда
- •Требования к отчёту
- •Контрольные вопросы
- •Основные свойства резин
- •Резины общего назначения
- •Резины специального назначения
- •Порядок выполнения исследования на растяжение:
- •Порядок проведения исследования резины после старения
- •Исследование изменения твердости резин в зависимости от их старения
- •Исследование набухаемости резин
- •Испытание резины на растяжение
- •Испытание резины натвёрдость
- •Вопросы для контроля
- •Рекомендуемая литература
- •Металловедение цветных сплавов и резин
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ИРКУТСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Материаловедение цветных сплавов и резин
Методические указания
ИЗДАТЕЛЬСТВО
Иркутского государственного технического университета
2011
Материаловедение цветных сплавов и резин : метод. указания / сост. Г.И. Бузевич. –Иркутск : Изд-во ИрГТУ, 2011.– 45 с.
Соответствует содержанию разделов государственного образовательного стандарта по направлению 150700 "Машиностроение".
Изложен порядок проведения лабораторных работ, контрольные вопросы и задания.
Предназначено для студентов специальности 151000.62-1 "Технология машиностроения". Может быть использовано студентами авиационных, энергетических, горных, металлургических специальностей.
Рецензент: канд. тех. наук, доцент кафедры машиностроительных технологий и материалов Гусева Е.А.
© Иркутский государственный
технический университет, 2011
Лабораторная работа 1 Исследование коррозионной стойкости конструкционных материалов
Цель работы: исследовать стали, никелевые сплавы, дуралюмины на коррозионную стойкость, провести исследование микроструктур указанных материалов и сделать выводы о влиянии состава и структуры сплавов, а также защитных покрытий на коррозионную стойкость сплавов.
Общие сведения
Коррозией называют самопроизвольное разрушение металлических материалов вследствие химического или электрохимического взаимодействия их с окружающей средой.
По механизму различают химическую и электрохимическую коррозию. Химическая коррозия возникает при взаимодействии металлов с сухими газами: воздухом, углекислым газом, сухим водяным паром, кислородом, продуктом сгорания топлив, при повышенных и высоких температурах (газовая коррозия) либо с неэлектролитами: бензином, спиртом, жидким топливом (коррозия в неэлектролитах). Электролитическая коррозия протекает в жидких электро-литах: влажных атмосфере и почве, морской и речной воде, водных растворах солей, щелочей и кислот. При электрохимической коррозии происходит растворение металла вследствие электрохимического взаимодействия с элек-тролитом.
Ионы металла на поверхности детали легко отрываются поляризо-ванными молекулами воды. Металл, потеряв часть положительно заряженных ионов, заряжается отрицательно за счет избыточного количества оставшихся электронов. Одновременно слой воды, прилегающий к металлу, приобретает положительный заряд за счет положительных ионов металла.
Разность зарядов на границе металл – вода обуславливает скачок потенциала, который в процессе коррозии изменяется, увеличиваясь от растворения металла и уменьшаясь от осаждения ионов из раствора на металл.
Если количество ионов, переходящих в раствор и осаждающихся из раствора на металле одинаково, то скорости растворения и осаждения равны и процесс коррозии (разрушение металла) не происходит. Этому соответствует равновесный потенциал. Равновесный потенциал водородного иона в водном растворе при концентрации H+ ионов, равный 1 моль ионов H+ на 1 литр, принято считать равными 0.
Вода, являющаяся
средой, где происходит коррозия, частично
диссоци-ирована на ионы H2O![]() H++OH-
.
H++OH-
.
Стандартные потенциалы других элементов измерены по отношению к водородному потенциалу и относятся к элементам, находящимся в растворе своих солей, содержащих 1 моль ионов H+ элемента в 1 литре.
Металлы, стандартный потенциал которых отрицательней, чем водо-родный, корродируют в воде, в которой растворен кислород. От металла с отрицательным стандартным потенциалом, находящегося в воде или во влажной атмосфере, будут уходить в растворы ионы металла
Me Men++ne,
которые, взаимодействуя
с гидроксил-ионами
![]() ,
образуют гидроксиды, нерастворимые в
воде. Их называют ржавчиной, а процесс
их образования – ржавением
,
образуют гидроксиды, нерастворимые в
воде. Их называют ржавчиной, а процесс
их образования – ржавением
Men++OH-→MeOH.
Схема электролитического процесса ржавения железа следующая:
![]() ;
;
![]() .
.
Гидроксид железа
![]() - нерастворимое соединение, поэтому
равновесный потенциал не может быть
достигнут и коррозия железа происходит
до полного разрушения металла.
- нерастворимое соединение, поэтому
равновесный потенциал не может быть
достигнут и коррозия железа происходит
до полного разрушения металла.
Металлы, стандартный потенциал которых положителен, достаточно коррозионно-стойки.
Однофазные сплавы более коррозионно-стойкие, нежели многофазные, так как анодами в них являются дефектные участки кристаллов: высоко - и малоугловые границы, дислокации. При коррозии разрушаются лишь анодные участки, площадь которых невелика. Это уменьшает скорость коррозии.
Мелкокристаллический поликристалл корродирует быстрее, чем крупнокристаллический и тем более монокристалл. Этим же объясняется повышенная коррозионная стойкость закаленных сталей и дуралюминов по сравнению с отожженными и отпущенными многофазными структурами сталей и сплавов.
Процесс коррозии сплавов, структура которых состоит из разных фаз, имеющих разные значения стандартных потенциалов, рассмотрим на рис.1. 1.
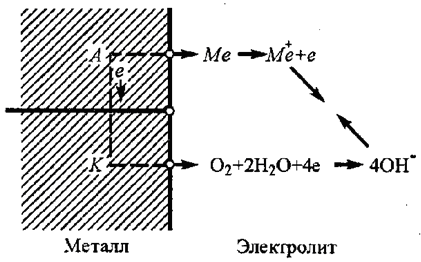
Рис. 1. 1. Схема коррозионного элемента
Поверхность металла в электролите электрохимически неоднородна. На одних участках поверхности потенциал более положителен ( фаза А является катодом), чем на других (фаза В является анодом). Они образуют гальванический коррозионный элемент. Фаза В, отдавая ионы в электролит, заряжается отрицательно.
На аноде Me'→Men++ne.
В растворе
положительные ионы фазы В взаимодействуют
с отрица-тельными ионами гидроксила
и образуют продукт коррозии гидроксид
металла фазы В. Избыточные ионы
![]() в растворе нейтрализуются электронами
около фазы А и удаляются в виде
газообразного водорода.
в растворе нейтрализуются электронами
около фазы А и удаляются в виде
газообразного водорода.
На катоде ![]() ,
,
![]() .
.
Как видно, коррозия подобного двухфазного сплава приводит к образованию микрогальванического коррозионного элемента. Интенсивность коррозии В фазы в таком сплаве выше, чем в случае однофазного сплава. С увеличением дисперсности площадь катодных включений уменьшается, коррозия растет. Именно поэтому отожженный дуралюмин не обладает коррозионной стойкостью.
По характеру разрушения различают равномерную и локальную (местную) коррозию.
Равномерная происходит равномерно по всей поверхности, т. е. протекает с одинаковой скоростью. Локальная охватывает только некоторые участки поверхности. Разновидностями последней являются точечная, язвенная, пятнами, межкристаллитная, коррозия под напряжением, получившие свое название от характера разрушаемых участков при образовании локальных коррозионных элементов. Неоднородный (многофазный) металл корродирует обычно локально. Очаги локальных коррозий являются концентраторами напряжений, способствуют образованию и развитию трещин, особенно в условиях циклически изменяющихся напряжений, что существенно снижает надежность и долговечность изделий. Например, в летательных аппаратах максимальный ущерб наносят равномерная коррозия, приводящая к необратимым потерям массы металла, а также язвенная, межкристаллитная и коррозия под напряжением.
Межкристаллитная коррозия (МКК) – хрупкое коррозионное разрушение по границам кристаллов, возникающее в результате структурных превращений при обработке и эксплуатации материала. При изгибе металла с межкристаллитной коррозией образуются надрывы по границам зерен в местах коррозионного разрушения металла. Опасность межкристаллитной коррозии в том, что она развивается без заметных признаков в глубь материала по границам зерен (вследствие более низкого их электрохимического потенциала), вызывая потери прочности и пластичности и приводя к преждевременному разрушению конструкции.
Коррозия под напряжением – это разрушения при одновременном дей-ствии коррозионной среды и напряжений растяжений, не превышающих σ0,2. Разновидностью является коррозионное растрескивание, т. е. образование тонкой сетки трещин, проходящих по объему зерна при воздействии коррозионной среды и напряжений.
Материалы, склонные к коррозии под напряжением, могут быстро разрушаться от коррозионного растрескивания даже при хорошей общей коррозионной стойкости.
Коррозию оценивают количественно по удельной потере массы в единицу времени (скорость равномерной коррозии мг/м2·с) оксидной пленки или по изменению толщины оксидной пленки за определенный период времени (мкм/час).
Степень разрушения при локальной коррозии определяют косвенными методами – по интенсивности изменения физико-химических свойств.
Стали, устойчивые против электрохимической коррозии, называют коррозионно-стойкими (нержавеющими) сталями.
В основе химической коррозии лежат процессы окисления с образованием тонких оксидных пленок. При невысоких температурах (20–25 °С) толщина пленок составляет 3–10 нм, они покрывают поверхность материала сплошным слоем. Кристаллическая решетка таких оксидов подобна решетке металла. При образовании оксидного слоя, хорошо связанного с основой, плотный оксидный слой подавляет диффузию реагирующих элементов через него и дальнейшее окисление приостанавливается. С повышением температуры скорость диффузии реагирующих элементов возрастает, толщина оксидного слоя увеличивается, и даже в сухих газах, ввиду разницы объема оксида и металла, часто оксидный слой растрескивается, что резко ускоряет окислительный процесс. Кристаллическая решетка оксида по мере удаления от поверхности металла приближается к решетке компактного оксида. Защитные свойства плотной оксидный пленки зависят от диффузионной подвижности ионов металла и кислорода. Недостаток ионов металла или кислорода в узлах решетки оксида или избыток металла между узлами, занятыми ионами кислорода, ускоряют диффузию и уменьшают защитные свойства оксида. Легирование элементами с большей активностью к кислороду, чем основной металл, сопровождается накапливанием этих ионов в оксидном слое, уменьшением дефектности кристаллической решетки и повышением защитных свойств оксидной пленки.
Например, в хромистых сталях, начиная с 13% хрома, вместо оксида FeO образуется шпинель MeO·Me2O3. Вода, влажный воздух, водяной пар относятся к нейтральным средам (равенство ионов H+ и ОН-), но в присутствии загрязнений, растворенных солей, газов (СО2, SO2, оксидов азота и др.) из окружающей среды, они могут стать как щелочными (при увеличении ОН-), так и кислыми (больше Н+). Такие электролиты способны растворять образующиеся на поверхности металлов защитные пленки и резко ускорять коррозионные процессы в результате развития электрохимической коррозии.
Разрушение от химической коррозии в неэлектролитах происходит в результате химического взаимодействия металлов с различными органическими соединениями, присутствующими в этих жидкостях (дисульфиды, сероводород, меркоптан, коллоидная сера и др.) с образованием в качестве основных продуктов коррозии различных сульфидов.
Химическую коррозию стимулируют смазочные масла, применяемые в механизмах машин и в авиационных конструкциях. Сами они не действуют, но под влиянием температуры, давления, трения, кислорода и каталитического действия металлов могут разлагаться с выделением органических кислот, альдегидов, перекисей и других активных продуктов, вызывающих коррозию металлов и сплавов.
Образование оксидных пленок с высокими защитными свойствами Cr2O3 или NiCr2O4 на поверхности хрома и его сплавов, высоколегированных хромом сталей, хромоникелевых сплавов обуславливает высокую устойчивость этих материалов против химической газовой коррозии. На никелевых сплавах образуется оксидная пленка из плотной шпинели NiO·Cr2O3 и оксида Cr2O3.
Магний не создает надежной защитной пленки из оксида магния из-за её несплошности.
Непассивирующиеся металлы, такие как золото, платина, серебро, медь, (электроположительные металлы), олово, свинец, (потенциал которых имеет небольшое электроотрицательное значение), обладают коррозионной стойкостью во многих средах, в том числе во влажной атмосфере и многих органических кислотах.
Медные сплавы имеют высокую коррозионную стойкость в условиях равномерной атмосферной и морской коррозии. Латуни корозионно-стойки при равномерной коррозии, но склонны к коррозионному растрескиванию во влажной атмосфере. При большом содержании цинка в латуни происходит избирательное поверхностное электрохимическое растворение электроотрицательного цинка.
Оксидная пленка FeO образуется и у железа, но она мало устойчива. Оксидную пленку железа можно упрочнить, воздействуя сильными окислителями, богатыми кислородом, например, концентрированной азотной кислотой. После такой обработки железо становится пассивными к действию водных растворов. Это явление называется пассивированием.
Однако действие пассиватора у железа недолговременно, оксид железа разрушается в кислой среде, происходит депассивация. В морской воде депассивация может проходить ионами хлора. После разрушения оксидов коррозия продолжается.
Титан сохраняет пассивность во влажной атмосфере даже при нагреве, в неокислительных, окислительных и органических кислотах, в морской воде, а также горячих щелочах.
Алюминий пассивен во влажной атмосфере, окислительных и органических кислотах, но в щелочах корродирует с большой скоростью.
