
- •Пояснительная записка
- •Тематический план
- •Методические рекомендации по изучению тем дисциплины
- •Методика решения задач
- •Варианты домашней контрольной работы
- •Задания для домашней контрольной работы
- •Критерии оценки домашней контрольной работы
- •Вопросы для самостоятельной подготовки к текущей аттестации
задания 1,2,3 относятся к разделу «Белковые вещества»;
задания 4,5,6,39 - см. раздел «Жиры» («Липиды»);
задания 7,8,9,10,11,12,13,40,41,42,43,44,45 - см. раздел «Углеводы»;
задания 14,15,16,17,18,20,46,47,48,49,50 относятся к разделу «Карбоновые кислоты»;
при ответе на вопрос 19 см. раздел «Спирты»;
вопросы 24,25 относятся к разделу «Пищевые добавки».
Методика решения задач
Внимательно прочитайте условие задачи и выясните, что необходимо вычислить в ходе решения.
Напишите уравнение реакции, по которому необходимо проводить вычисления.
Сверху над уравнением реакции напишите, что надо найти, что дано.
Внизу под веществами в уравнении реакции написать молярные массы веществ, необходимые для вычисления
На основании химического уравнения составить пропорцию и решить относительно неизвестного вещества.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1
Вычислить объём углекислого газа образовавшегося из 500 г глюкозы при спиртовом брожении, если глюкоза содержит 5% примесей.
Решение:
Для решения задачи необходимо воспользоваться уравнением:
5 00
г, 5% - прим. Хл
00
г, 5% - прим. Хл
 С6Н12О6
2С2Н5ОН
+ 2СО2
С6Н12О6
2С2Н5ОН
+ 2СО2
m=180 г V=44.8
Необходимо вычислить, сколько чистой глюкозы содержится в 500 г. На её долю приходится 100 – 5 = 95%.
Составляем пропорцию:
500 г глюкозы – составляет 100%
Х г глюкозы – составляет 95%
Х=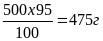
По уравнению реакции рассчитываем объём водорода:
180 г глюкозы образует 44,8 л СО2
475 г глюкозы образует ХлСО2
Х
=
Ответ: выделилось 118,2 л СО2
Задача № 2
Из 500 г крахмала образовалось 480 г глюкозы. Сколько составляет в % от теоретически возможного?
Решение:
Решаем задачу на основании уравнения:
500г 480 г
(С6Н10О5)n + nН2О nС6Н12О6
m = 162 г m = 180 г
Находим молярные массы веществ:
М(С6Н10О5) = 162 г/моль
М(С6Н10О6) = 180 г/моль
Определяем по уравнению реакции теоретический выход глюкозы:
162 г крахмала образуют 180 г глюкозы
500 г крахмала образуют Х г глюкозы
Х
=

Выход глюкозы определяем по формуле:
n
=
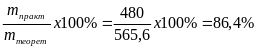
Ответ: выход глюкозы составляет 86,4%.
При решении задач по органической химии учащимся необходимо:
1. Уметь вычислять молярные массы веществ.
Например: М(Н2SО4) = 1 * 2 + 32 + 4 * 16 = 98 г/моль
2. Помнить, что процентное содержание веществ вычисляется относительно 100%.
Например: найти содержание клетчатки (целлюлозы) в 250 кг древесины,
содержащей 50% чистой клетчатки.
250 кг древесины составляют – 100%
Х кг клетчатки составляю – 50%
Отсюда
Х =
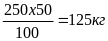
3. Помнить, что практический выход всегда меньше теоретического. Теоретический выход вещества всегда рассчитывается по уравнению реакции, и он приравнивается к 100%.
4. Для вычисления практического выхода можно воспользоваться формулой .
Ппракт.=
 ;
;
где: mпракт. – масса вещества, получившаяся в ходе химической реакции;
mтеорет.- масса вещества, рассчитанная по уравнению химической реакции.
5. Уметь писать химические уравнения реакций (или уметь найти их в учебнике).
Варианты домашней контрольной работы
Б А |
Последняя цифра номера личного дела |
||||||||||||||||
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
||||||||
Предпоследняя цифра номера личного дела |
0 |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
||||||
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
||||||||
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
||||||||
40 |
39 |
38 |
37 |
36 |
35 |
34 |
33 |
32 |
31 |
||||||||
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
41 |
42 |
||||||||
1 |
9 |
10 |
7 |
6 |
5 |
4 |
3 |
1 |
8 |
2 |
|||||||
19 |
18 |
20 |
17 |
16 |
15 |
14 |
12 |
13 |
11 |
||||||||
30 |
29 |
28 |
27 |
26 |
25 |
24 |
23 |
21 |
22 |
||||||||
39 |
40 |
37 |
38 |
31 |
32 |
33 |
34 |
35 |
36 |
||||||||
42 |
41 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
||||||||
2 |
8 |
7 |
10 |
5 |
4 |
6 |
2 |
1 |
9 |
3 |
|||||||
18 |
19 |
17 |
20 |
12 |
14 |
13 |
15 |
11 |
16 |
||||||||
22 |
23 |
24 |
25 |
21 |
27 |
28 |
29 |
30 |
26 |
||||||||
38 |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
39 |
40 |
||||||||
41 |
42 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
43 |
||||||||
3 |
7 |
6 |
9 |
10 |
3 |
2 |
1 |
8 |
5 |
4 |
|||||||
17 |
18 |
19 |
16 |
20 |
11 |
12 |
14 |
13 |
15 |
||||||||
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
22 |
21 |
||||||||
37 |
38 |
31 |
32 |
33 |
34 |
35 |
36 |
40 |
39 |
||||||||
50 |
49 |
48 |
47 |
41 |
42 |
43 |
44 |
45 |
46 |
||||||||
4 |
6 |
7 |
8 |
9 |
10 |
1 |
2 |
3 |
4 |
5 |
|||||||
16 |
15 |
14 |
13 |
12 |
20 |
18 |
19 |
17 |
11 |
||||||||
24 |
26 |
27 |
28 |
29 |
30 |
21 |
22 |
23 |
25 |
||||||||
36 |
37 |
40 |
31 |
32 |
33 |
34 |
35 |
39 |
38 |
||||||||
49 |
50 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
43 |
||||||||
Б А |
Последняя цифра номера личного дела |
||||||||||||||||
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
||||||||
Предпоследняя цифра номера личного дела |
5 |
5 |
4 |
3 |
2 |
1 |
10 |
7 |
9 |
8 |
6 |
||||||
15 |
14 |
13 |
12 |
11 |
16 |
20 |
19 |
18 |
17 |
||||||||
25 |
27 |
28 |
30 |
29 |
21 |
22 |
23 |
24 |
26 |
||||||||
40 |
39 |
33 |
34 |
35 |
36 |
37 |
38 |
31 |
32 |
||||||||
48 |
47 |
50 |
49 |
44 |
45 |
46 |
41 |
43 |
42 |
||||||||
6 |
4 |
3 |
2 |
1 |
8 |
9 |
10 |
6 |
5 |
7 |
|||||||
14 |
15 |
13 |
12 |
17 |
16 |
11 |
20 |
19 |
18 |
||||||||
26 |
28 |
29 |
30 |
21 |
22 |
23 |
24 |
25 |
27 |
||||||||
32 |
31 |
34 |
35 |
36 |
37 |
38 |
33 |
39 |
40 |
||||||||
47 |
48 |
49 |
50 |
42 |
43 |
44 |
45 |
46 |
41 |
||||||||
7 |
3 |
2 |
1 |
4 |
5 |
7 |
9 |
10 |
6 |
8 |
|||||||
13 |
18 |
15 |
16 |
14 |
12 |
17 |
11 |
20 |
19 |
||||||||
27 |
29 |
30 |
21 |
22 |
23 |
24 |
25 |
26 |
28 |
||||||||
31 |
33 |
32 |
34 |
35 |
36 |
39 |
37 |
40 |
38 |
||||||||
46 |
45 |
47 |
48 |
50 |
49 |
41 |
42 |
43 |
44 |
||||||||
8 |
2 |
1 |
6 |
7 |
3 |
8 |
4 |
5 |
10 |
9 |
|||||||
12 |
13 |
14 |
11 |
19 |
16 |
15 |
17 |
20 |
18 |
||||||||
28 |
30 |
22 |
23 |
24 |
25 |
26 |
27 |
29 |
21 |
||||||||
40 |
38 |
39 |
36 |
37 |
31 |
32 |
33 |
43 |
35 |
||||||||
45 |
46 |
42 |
41 |
43 |
44 |
50 |
47 |
48 |
49 |
||||||||
9 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|||||||
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
||||||||
30 |
21 |
28 |
27 |
26 |
24 |
25 |
23 |
22 |
29 |
||||||||
39 |
40 |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
||||||||
44 |
41 |
46 |
45 |
49 |
50 |
48 |
43 |
42 |
47 |
||||||||
