
- •1.Основные понятия теории ошибок. Дисперсия и стандартное отклонение.
- •2.Ошибки измерения, ошибки истинного значения и методы их оценки.
- •3. Основная характеристика титриметрического анализа, достоинства и недостатки, классификация по типам реакции, лежащих в основе титрования.
- •4. Дайте определение понятию эквивалент, индикатор, конечная точка титрования.
- •5. Щелочное число нефтепродуктов.
- •6. Кислотное число нефтепродуктов.
- •7. Классификация титриметрических методов анализа
- •8. Физико-химические свойства гсм
- •9.Основная характеристика хроматографического метода анализа, достоинства и недостатки
- •10.Классификация методов хроматографического анализа, их характеристика
- •11. Виды хромотографии. Классификация по механизму межфазного распределения сорбента.
- •12. Закон Рауля. Давление насыщенных паров бензина.
- •13. Классификация физико-химических методов анализа гсм.
- •14. Электрохимические методы анализа, классификация, достоинства и недостатки.
- •15. Денсиметрия.
- •16. Вязкость нефтепродуктов.
- •17. Что такое динамическая и кинематическая вязкость? Поясните их физический смысл.
- •18. Колориметрия.
- •19. PH метрия.
- •20. Спектральный анализ. Виды. Характеристики.
- •21. Фракционная перегонка
- •22. Азеотропные растворы
- •23. Почему на нефтеперерабатывающих заводах проводят доочистку нефти?
- •25. Почему кислотность и щелочность нефтей должна постоянно контролироваться?
- •26. Как нормируется кислотность для автомобильных и авиационных бензинов?
- •27. Флюидная хроматография
- •28. Определение содержания кислот в нефтепродуктах путем титрования.
- •29. Определить массовую долю (%) компонентов газовой смеси по следующим данным:
- •31, 40!! Гжх-анализ бензина дал следующие значения площадей пиков…
- •34 Ежедневный анализ нп в сточных водах дал следующие результаты в мг/л: 0,38; 0,32; 0,31; 0,32; 0,33; 0,29; 0,32; 0,32; 0,33;0,39
- •38. Какой объем воздуха требуется для сгорания 100л петролейной фракции нефти
- •41. При аварии танкера у берегов Франции было выброшено в море 230 тыс.Т. Нефти. Рассчитайте объем воды, в котором погибла рыба, если гибель рыбы происходит при концентрации нефти 15 мг/л.
1.Основные понятия теории ошибок. Дисперсия и стандартное отклонение.
Дисперсия
Дисперсия в статистике очень важный показатель, который активно используется в других видах статистического анализа (проверка гипотез, анализ причинно-следственных связей и др.). При расчете также находится разница каждого элемента со средним, но перед суммированием она возводится в квадрат. Квадрат любого числа всегда положительный, поэтому модули в формуле уже не нужны.
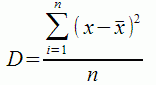
D – дисперсия,
x – анализируемый показатель, с черточкой сверху – среднее значение показателя,
n – количество значений в анализируемой совокупности данных.
Из-за возведения отклонений от среднего в квадрат дисперсия имеет значение на порядок выше, чем среднее отклонение. Как конечное значение она используется редко, это скорее промежуточный показатель, который используется для других видов статистического анализа.
Стандартное отклонение
Это квадратный корень из дисперсии, обозначается греческой буквой сигма. Полученное значение можно использовать как для оценки вариации, ведь после извлечения корня его можно сравнивать с исходными данными, так как единицы измерения у них одинаковые.
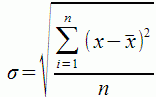
Но и сам по себе показатель стандартного отклонения (σ) теперь может использоваться как единица измерения. Например, известно правило трех сигм, которое гласит, что в данных с нормальным распределением 997 значений из 1000 будут находиться не далее, чем 3 сигмы в ту или иную сторону от среднего значения.
2.Ошибки измерения, ошибки истинного значения и методы их оценки.
Измерением называют совокупность действий, выполняемых при помощи средств измерений с целью нахождения числового значения измеряемой величины в принятых единицах измерения.
Цель измерений – получение надежных, достоверных результатов. Поэтому полученный количественный результат характеризуется тремя параметрами: значением измеряемой величины, ошибкой измерения, количественным значением вероятности результата.
Точность измерений отражает близость результатов к истинному значению измеряемой величины.
Грубые ошибки – единичные результаты измерений, резко выпадающие из всего ряда измерений вследствие резких нарушений режима нарушений.
Систематические ошибки – не меняют своего значения от измерения к измерению, могут быть вызваны неправильной калибровкой посуды, термометра, показанием приборов.
Случайные ошибки. Измеряемая величина и ее истинное значение не совпадают друг с другом ввиду отличий от нуля ошибки эксперимента.
Истинное значение измеряемой величины оценивается среднеарифметической величиной множества результатов измерения

где
 -
среднеарифметическое значение множества
различных измерений.
-
среднеарифметическое значение множества
различных измерений.
3. Основная характеристика титриметрического анализа, достоинства и недостатки, классификация по типам реакции, лежащих в основе титрования.
Титриметрический анализ – один из разделов количественного анализа, основанный на точном измерении объема и концентрации раствора реагента (титранта), вступившего в химическую реакцию с определяемым веществом. Раствор титранта также называют стандартным, или титрованным рабочим раствором, а определяемое вещество – титруемым раствором. Титриметрия основана на законе действующих масс (Гульдберг и Вааге), согласно которому существует равенство c1v1=c2v2, где с1 и с2 – молярные концентрации титруемого и титрующего раствора соответственно.
Титрование – процесс постепенно прибавления титрованного рабочего раствора к определяемому веществу. Титрование продолжают до тех пор, пока количество титранта не станет эквивалентным количеству реагирующего с ним определяемого вещества.
Химические реакции, применяемые в титриметрических методах анализа, должны отвечать следующим требованиям: реакция должна протекать с достаточной скоростью и быть практически необратимой; взаимодействие между исследуемым веществом и титрантом должно происходить стехеометрично, с четким фиксированием конечной точки титрования; не должны протекать побочные реакции; в растворе должно отсутствовать вещества, мешающие ходу основной реакции или фиксированию конечной точки титрования.
Достоинства титриметрических методов анализа: быстрота проведения, высокая точность, простота используемой аппаратуры, возможность определения нескольких вещества в анализируемой пробе, возможность автоматизации процесса. Важнейшими моментами титриметрических определений являются: точное определение объемов реагирующих веществ, приготовление растворов точно известной концентрации, определение конца реакции. Для того, чтобы та или иная реакция могла служить основой для титрования, она должна удовлетворять ряду требования: реакция должна проходить количественно без побочных реакций, окончание реакций должно фиксироваться, реакция должна протекать с достаточно скоростью и быть практически необратимой.
Титриметрические методы классифицируют по типам реакций, лежащих в их основе, по титранту и по способу титрования.
Методы кислотно-основного титрования.
Эти методы основаны на использовании реакции нейтрализации. Применяют для определения кислот, оснований и солей, которые при гидролизе создают кислую или щелочную реакцию среды.
Методы осадительного титрования.
В этих методах исследуемое вещество при взаимодействии с титрантом образует малорастворимое соединение. Например, галогенид-ионы Hal-определяют титрованием стандартным раствором AgNO3.
Методы комплексиметрического титрования.
Эти методы основаны на образовании слабоионизированных комплексов титранта с исследуемым веществом. Например, галогенид-ионы Hal-определяют титрованием стандартным раствором Hg(NO3)2 (меркуриметрия)
Методы окислительно-восстановительного титрования (редокс-методы).
Эти методы основаны на окислительно-восстановительных реакциях между определяемым веществом и титрантом. В зависимости от свойств используемого титранта подразделяют на оксидиметрию и редукто-метрия.
