
- •Раздел 1 Общие сведения об алюминии
- •Тема 1.1 Свойства алюминия и его применение
- •Тема 1.2 История алюминиевой промышленности
- •Раздел 2 Руды Al
- •Тема 2.1 Распространение Al в природе
- •Тема 2.2 Бокситы
- •Тема 2.3 Нефелины, алуниты и другие виды сырья
- •Раздел 3 Cоединения Al
- •Тема 3.1 Оксиды и гидроксиды алюминия
- •Тема 3.2 Алюминатные растворы
- •Тема3.3 Диаграмма равновесных состояний системы .
- •1) − Обратная реакция;
- •2) − Прямая реакция.
- •Тема 3. 4 Стойкость алюминатных растворов
- •Тема 3. 5. Классификация способов производства глинозёма
- •Тема 3. 6. Характеристика глинозёма
- •Тема 4.1. Складирование.
- •Тема 4. 2. Дробление и измельчение.
- •Тема 5. 1. Общая схема процесса.
- •Тема 5. 2. Цикл процесса Байера в системе
- •Тема 5. 3. Дробление и размол боксита.
- •Тема 5. 4. Выщелачивание боксита.
- •Тема 5. 4. 1. Химизм процесса.
- •Тема 5. 4. 2. Влияние различных факторов на выщелачивание бокситов.
- •Тема 5. 4. 3. Расчётные формулы выщелачивания боксита.
- •Тема 5. 4. 4. Аппаратурно-технологическая схема выщелачивания.
- •Тема 5. 4. 5. Оборудование для выщелачивания боксита.
- •Тема 5. 4. 6. Разбавление автоклавной пульпы.
- •Тема 6. 1. Аппаратурно-технологическая схема сгущения.
- •Тема 6. 2. Теоретические основы сгущения.
- •Тема 6. 3. Оборудование для сгущения и промывки шлама.
- •Тема 6. 4. Контрольная фильтрация.
- •Тема 6. 5. Шламовое хозяйство.
- •Тема 7. 1. Теоретические основы процесса.
- •Тема 7. 2. Аппаратурно-технологическая схема декомпозиции.
- •Тема 7. 3. Устройство декомпозёров.
- •Тема 7. 3. 1. Объём алюминатного и маточного растворов.
- •Тема 7. 4. Охлаждение пульпы.
- •Тема 8. 1. Аппаратурно-технологическая схема.
- •Тема 8. 2. Оборудование для отделения гидроксида от маточного раствора.
- •Тема 8. 3. Качество гидроксида.
- •Тема 9. 1. Сущность процесса.
- •Тема 9. 1. 1. Основы процесса выпаривания.
- •Тема 9. 2. Аппаратурно-технологическая схема выпарки.
- •Тема 9. 3. Определение количества выпаренной воды и расхода греющего пара.
- •Тема 11. 1. Назначение кальцинации.
- •Тема 11. 2. Аппаратурно-технологическая схема кальцинации.
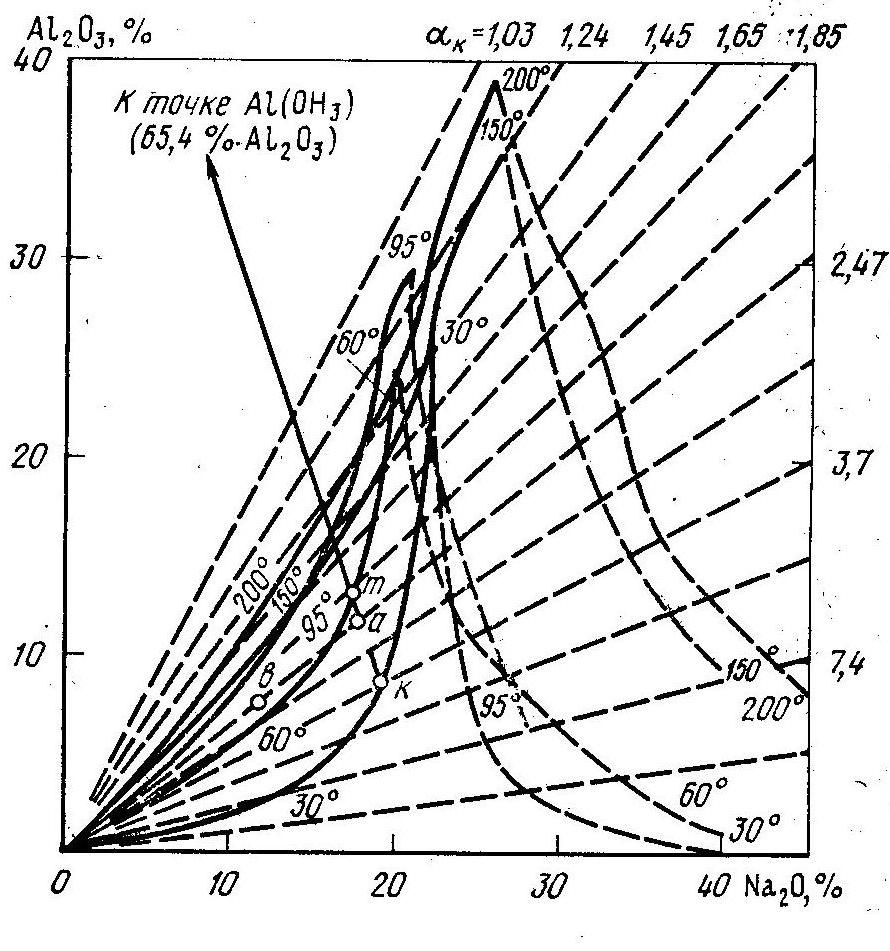
Тема3.3 Диаграмма равновесных состояний системы .
1) − Обратная реакция;
2) − Прямая реакция.
Реакция образования
алюмината натрия и реакция его с водой
(гидролиз) протекают в зависимости от
концентрации реагирующих веществ и
температуры с разной скоростью (если
скорость прямой реакции больше скорости
обратной реакции, то образуется
![]() и наоборот).
и наоборот).
Высокая концентрация щелочи, и высокая температура провоцируют снижение концентрации раствора. Понижение температуры процесса увеличивает скорость прямой реакции и в осадок выпадает . Наступает такой момент, когда скорость прямой и скорость обратной реакции будут равны, то есть наступает химическое равновесие.
Если
в системе
координат:
![]() нанести точки химического равновесия
растворов при определённых температурах,
то образуются кривые
изотермы,
состоящие из двух ветвей.
нанести точки химического равновесия
растворов при определённых температурах,
то образуются кривые
изотермы,
состоящие из двух ветвей.
Растворы, концентрация которых находятся выше левой ветви изотермы, содержат избыточный глинозём (пересыщены по глинозёму) и здесь скорость обратной реакции будет меньше скорости прямой реакции, то есть в осадок выпадает .
Между ветвями изотермы находятся растворы, не насыщенные глинозёмом, и в этой области преобладает скорость обратной реакции.
Выше правой
ветви
изотермы находятся растворы, пересыщенные
по щёлочи
![]() .
.
Рассмотрим раствор
при температуре
![]() ,
соответствующей по концентрации точке
а. Этот
раствор находится между ветвями изотермы
и в нём преобладает скорость обратной
реакции, то есть идет образование
.
,
соответствующей по концентрации точке
а. Этот
раствор находится между ветвями изотермы
и в нём преобладает скорость обратной
реакции, то есть идет образование
.
Образование алюмината натрия будет идти до тех пор, пока концентрация раствора не станет равновесной, то есть до точки m.
Раствор в точке
а при
![]() является пересыщенным
по глинозёму,
так как находится выше левой ветви
изотермы 30о.
Здесь преобладает скорость прямой
реакции.
является пересыщенным
по глинозёму,
так как находится выше левой ветви
изотермы 30о.
Здесь преобладает скорость прямой
реакции.
Значит, чтобы спровоцировать гидролиз алюмината натрия, то есть прямую реакцию, необходимо снизить температуру раствора.
Раствор в точке
а имеет каустический модуль
![]() .
.
Тема 3. 4 Стойкость алюминатных растворов
Стойкость алюминатных растворов – это способность растворов находится длительное время без видимого разложения при концентрациях близких или равных равновесным.
Различают теоретическую и практическую стойкость.
Теоретически стойкие – это растворы, концентрация глинозема в которых ниже или равна равновесной, то есть расположенные между ветвями изотерм и на левых их ветвях.
Практически стойкие растворы находятся без видимого разложения даже при пересыщенных концентрациях, так как алюминатный раствор разлагается очень медленно благодаря примесям, оказывающим стабилизирующее действие.
Для характеристики стойкости раствора вводится понятие коэффициент пересыщения:
 .
.
Для определения
степени пересыщения раствора точку,
соответствующую состоянию раствора,
соединяют прямой линией с точкой
гидраргилита (гиббсита)
![]() и продолжают эту линию до пересечения
с левой ветвью изотермы равновесия.
Концентрация равновесного раствора
соответствует точке на изотерме.
и продолжают эту линию до пересечения
с левой ветвью изотермы равновесия.
Концентрация равновесного раствора
соответствует точке на изотерме.
На стойкость раствора влияет ряд факторов: температура, концентрация раствора, каустический модуль, наличие в растворе примесей и осадка .
1. Понижение температуры провоцирует реакцию гидролиза, то есть снижение стойкости раствора. Однако снижение температуры ниже приводит к дальнейшему повышению стойкости. Это объясняется увеличением вязкости раствора и как следствие замедление реакции.
2. Снижение концентрации раствора при постоянной температуре тоже снижает стойкость.
3. Чем выше
каустический модуль
![]() ,
тем больше стойкость.
,
тем больше стойкость.
4. Примеси присутствующие в растворе действуют не одинаково:
− органические
вещества, повышающие стойкость:
![]() ,
(сода);
,
(сода);
− вещества,
снижающие резко стойкость:
![]() ,
,
![]() .
.
5. Присутствующие в растворе кристаллы являются готовыми центрами кристаллизации. Вокруг них быстрее формируются кристаллы из растворов.
6. Другие свойства растворов, такие как электропроводность, плотность, вязкость, значительно зависят от температуры концентрации, и в каждом отдельном случае определяется экспериментальным и теоретическим путём.
