
- •1. История развития представлений о структуре атома. Теории Ломоносова и Дальтона. Модели атомов Томсона, Резерфорда, Бора.
- •4. Связь электронного строения атома и его валентными возможностей с положением элемента в псхэ
- •5. Определение и характеристики химической связи. Теории Бутлерова, Косселя, Льюиса. Основные виды х.С.
- •Типы связи
- •Теория химического строения Бутлерова
- •6. Ковалентная связь. Обменный донорно-акцнпторный м-зм
- •7. Ионная связь
- •9.Комплексные соединения. Д-а взаимодействием молекул. Комплексообразование. Лиганды.
- •10. Природа хим связи в комплексах. Структура и свойства комплексных соединений. Изомерия комплексов. Химическая связь в комплексных соединениях и их строение
- •17.5. Химические свойства комплексных соединений
- •17.6. Изомерия комплексных соединений
- •11. Биологические важные комплексные соединения(гемоглобин, хлорофилл, витамин в12 и т.Д.)
- •12. Использование комплексных соединений в медицине, фармецевтике, промышленности.
- •13. Микроэлементы
- •14.Микроэлементы
- •15.Макроэлементы.
- •16.Микроэлементозы.А.П. Авцин
17.5. Химические свойства комплексных соединений
Для комплексных соединений прежде всего характерны те же свойства, что и для обычных соединений тех же классов (соли, кислоты, основания).
Если комплексное соединение кислота, то это сильная кислота, если основание, то и основание сильное. Эти свойства комплексных соединений определяются только наличием ионов H3O или OH . Кроме этого комплексные кислоты, основания и соли вступают в обычные реакции обмена, например:
[Cu(NH3)4]SO4 +
BaCl2 =
BaSO4![]() +
[Cu(NH3)4]Cl2
FeCl3 +
K4[Fe(CN)6]
= Fe4[Fe(CN)6]3
+
3KCl
+
[Cu(NH3)4]Cl2
FeCl3 +
K4[Fe(CN)6]
= Fe4[Fe(CN)6]3
+
3KCl
Последняя из этих реакций используется в качестве качественной реакции на ионы Fe3 . Образующееся нерастворимое вещество ультрамаринового цвета называют " берлинской лазурью" [систематическое название – гексацианоферрат(II) железа(III)-калия].
Кроме этого в реакцию может вступать и сама комплексная частица, причем, тем активнее, чем она менее устойчива. Обычно это реакции замещения лигандов, протекающие в растворе, например:
[Cu(H2O)4]2 + 4NH3 = [Cu(NH3)4]2 + 4H2O,
а также кислотно-основные реакции типа
[Zn(OH)4]2 + 2H3O = [Zn(H2O)2(OH)2] + 2H2O [Zn(H2O)4]2 + 2OH = [Zn(H2O)2(OH)2] + 2H2O
Образующийся в этих реакциях [Zn(H2O)2(OH)2] после выделения и высушивания превращается в гидроксид цинка:
[Zn(H2O)2(OH)2] = Zn(OH)2 + 2H2O
Последняя реакция – простейший пример разложения комплексного соединения. В данном случае она протекает при комнатной температуре. Другие комплексные соединения разлагаются при нагревании, например:
[Cu(NH3)4]SO4.H2O = CuSO4 + 4NH3 + H2O (выше 300 oС) 4K3[Co(NO2)6] = 12KNO2 + 4CoO + 4NO + 8NO2 (выше 200 oС) K2[Zn(OH)4] = K2ZnO2 + 2H2O (выше 100 oС)
Для оценки возможности протекания реакции замещения лигандов можно использовать спектрохимический ряд, руководствуясь тем, что более сильные лиганды вытесняют из внутренней сферы менее сильные.
[предыдущий раздел] |
[содержание] |
[следующий раздел] |
17.6. Изомерия комплексных соединений
Изомерия комплексных соединений связана 1) с возможным различным расположением лигандов и внешнесферных частиц, 2) с различным строением самой комплексной частицы.
К первой группе относится гидратная (в общем случае сольватная) и ионизационная изомерия, ко второй – пространственная и оптическая.
Гидратная изомерия связана с возможностью различного распределения молекул воды во внешней и внутренней сферах комплексного соединения, например: [Cu(H2O)2Br2] (цвет красно-коричневый) и [Cu(H2O)4]Br2 (цвет голубой).
Ионизационная изомерия связана с возможностью различного распределения ионов во внешней и внутренней сфере, например: [Co(NH3)5Br]SO4 (пурпурного цвета) и [Co(NH3)5SO4]Br (красного цвета). Первое из этих соединений образует осадок, реагируя с раствором хлорида бария, а второе – с раствором нитрата серебра.
Пространственная (геометрическая) изомерия, иначе называемая цис-транс изомерией, характерна для квадратных и октаэдрических комплексов (для тетраэдрических невозможна). Пример: цис-транс изомерия квадратного комплекса [Pt(NH3)2Cl2]
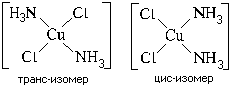
Оптическая (зеркальная) изомерия по своей сути не отличается от оптической изомерии в органической химии и характерна для тетраэдрических и октаэдрических комплексов (для квадратных невозможна).
